Publikasi baru
TIVDAK® yang disetujui FDA: Menargetkan faktor jaringan pada kanker serviks
Terakhir ditinjau: 02.07.2025

Semua konten iLive ditinjau secara medis atau diperiksa fakta untuk memastikan akurasi faktual sebanyak mungkin.
Kami memiliki panduan sumber yang ketat dan hanya menautkan ke situs media terkemuka, lembaga penelitian akademik, dan, jika mungkin, studi yang ditinjau secara medis oleh rekan sejawat. Perhatikan bahwa angka dalam tanda kurung ([1], [2], dll.) Adalah tautan yang dapat diklik untuk studi ini.
Jika Anda merasa salah satu konten kami tidak akurat, ketinggalan zaman, atau dipertanyakan, pilih dan tekan Ctrl + Enter.
Pada tanggal 29 April 2024, Badan Pengawas Obat dan Makanan AS (FDA) memberikan persetujuan penuh kepada TIVDAK® (tisotumab vedotin) buatan Seagen Inc., obat yang menargetkan faktor jaringan (TF), untuk pengobatan pasien dengan kanker serviks berulang atau metastasis yang telah berkembang selama atau setelah kemoterapi. Hal ini merupakan terobosan signifikan dalam terapi kanker serviks, yang menyoroti potensi konjugat obat antibodi (ADC) dalam onkologi.
Mekanisme kerja TIVDAK
Tivdak adalah ADC yang menargetkan TF dengan menggabungkan antibodi monoklonal anti-TF tisotumab milik Genmab dengan teknologi ADC milik Seagen yang dirancang untuk menargetkan antigen TF pada sel kanker dan memberikan komponen sitotoksik MMAE langsung ke sel kanker.
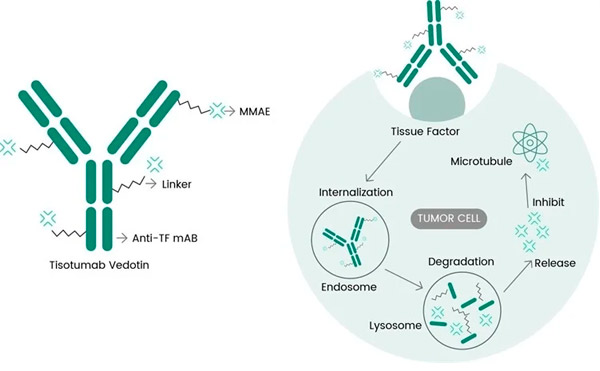
Mekanisme kerja molekuler tisotumab vedotin ( https://doi.org/10.3390/ijms23073559 )
TF: Target Sempurna untuk Pengembangan ADC
TF diketahui terlibat dalam pensinyalan tumor dan angiogenesis serta diekspresikan secara berlebihan pada sebagian besar pasien dengan kanker serviks dan banyak tumor padat lainnya. Kemampuannya untuk diinternalisasi dengan cepat setelah pengikatan antibodi dan dampaknya yang minimal pada pembekuan darah normal semakin meningkatkan kesesuaiannya untuk terapi kanker yang ditargetkan.
