Obat LM11A-31 memperlambat perkembangan penyakit Alzheimer dalam uji coba
Terakhir ditinjau: 14.06.2024

Semua konten iLive ditinjau secara medis atau diperiksa fakta untuk memastikan akurasi faktual sebanyak mungkin.
Kami memiliki panduan sumber yang ketat dan hanya menautkan ke situs media terkemuka, lembaga penelitian akademik, dan, jika mungkin, studi yang ditinjau secara medis oleh rekan sejawat. Perhatikan bahwa angka dalam tanda kurung ([1], [2], dll.) Adalah tautan yang dapat diklik untuk studi ini.
Jika Anda merasa salah satu konten kami tidak akurat, ketinggalan zaman, atau dipertanyakan, pilih dan tekan Ctrl + Enter.

Dalam penelitian terbaru yang diterbitkan di Nature Medicine, para peneliti melakukan uji coba Fase 2a secara acak, tersamar ganda, dan terkontrol plasebo untuk menguji keamanan dan efektivitas LM11A-31 dalam pengobatan penyakit Alzheimer (AD) melalui modulasi reseptor neurotropin p75 (p75NTR).
AD dengan awitan lambat adalah bentuk demensia yang paling umum, ditandai dengan kegagalan sinaptik, degenerasi, dan hilangnya sel-sel saraf. Meskipun dua obat utama untuk mengobati DA menargetkan akumulasi protein amiloid-β atau tau yang abnormal, obat-obatan tersebut hanya membahas sebagian dari patofisiologinya. Pendekatan lain adalah dengan menargetkan reseptor dan jaringan sinyal yang mempengaruhi jalur biologis mendasar. Studi praklinis menunjukkan bahwa modulasi p75NTR dengan molekul kecil baru LM11A-31 mengurangi hilangnya sinaptik yang disebabkan oleh amiloid dan tau patologis.
Deskripsi penelitian
Dalam uji klinis acak ini, para peneliti memeriksa apakah LM11A-31 dapat memperlambat perkembangan penyakit Alzheimer dengan memodulasi p75NTR pada manusia.
Peserta penelitian diberikan kapsul oral LM11A-31 dengan dosis 200 mg dan 400 mg atau plasebo dengan perbandingan 1:1:1 kepada 242 pasien asma ringan hingga sedang selama 26 minggu. Peserta telah dikonfirmasi secara biologis penyakit Alzheimer (kadar protein amiloid β 42 (Aβ42) cairan serebrospinal di bawah 550 ng/L atau rasio Aβ42:β40 di bawah 0,89), didiagnosis berdasarkan kriteria McKhann, dengan skor Mini Psychiatric SE (MMSE) 18 hingga 26, Skor Skala Depresi Geriatri (GDS) di bawah 5.0, skor Skala Iskemik Hacinski yang dimodifikasi (HIS) ≤ 4.0, pendidikan formal ≥ 8 tahun, dan penurunan kognitif sebelumnya ≥ 6 bulan.
Peserta yang memenuhi syarat telah menggunakan inhibitor asetilkolinesterase (AChEI) atau antagonis reseptor NMDA parsial ≥ 3 bulan sebelum studi dimulai. Mereka tidak mengonsumsi obat-obatan terlarang seperti antipsikotik, benzodiazepin, obat antiepilepsi, obat penenang, obat antihipertensi aktif sentral, nootropik (kecuali ginkgo biloba) atau analgesik yang mengandung opioid.
Hasil utama penelitian ini adalah keamanan dan tolerabilitas obat yang dinilai berdasarkan Skala Peringkat Keparahan Ide Bunuh Diri dan Perilaku Columbia (C-SSRS), tanda-tanda vital, tekanan darah, dan parameter hematologi. Pencitraan resonansi magnetik struktural (sMRI), tomografi emisi positron fluorodeoxyglucose (FDG-PET), dan biomarker cairan serebrospinal (CSF) digunakan untuk menilai hasil kognitif sekunder. Indikator AD termasuk tau terfosforilasi pada Thr181, total protein tau, Aβ40, Aβ42, dan aktivitas AChE. Tim menggunakan tes neuropsikologis individual untuk menilai hasil kognitif sekunder pada awal, minggu ke-12, dan 26.
Hasil penelitian
Studi ini menemukan bahwa LM11A-31 aman dan dapat ditoleransi dengan baik, tanpa masalah keamanan yang signifikan. Efek samping yang paling umum termasuk sakit kepala, diare, eosinofilia dan nasofaringitis, dengan masalah pencernaan dan eosinofilia menjadi alasan utama penghentian obat. Ada lebih banyak penghentian pada kelompok 400 mg dibandingkan dengan kelompok 200 mg dan plasebo. MRI tidak mengungkapkan masalah keamanan obat, termasuk kelainan terkait amiloid. Tidak ada perbedaan signifikan pada skor kognitif atau kelainan amiloid antara kedua kelompok perlakuan.
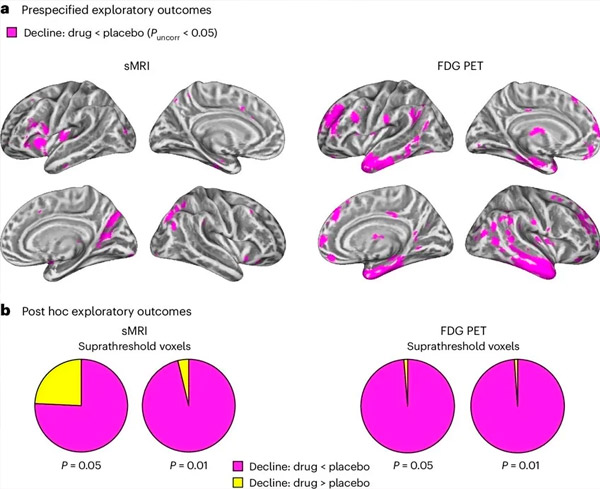
A. Model campuran dua faktor menganalisis interaksi kovarians antara pengobatan (obat atau plasebo) dan waktu (sebelum atau sesudah pengobatan). Kontras satu arah yang memeriksa hipotesis interaksi (obat memperlambat perkembangan dibandingkan dengan plasebo) menunjukkan bahwa pengobatan LM11A-31 memperlambat degenerasi longitudinal (panel kiri) dan hipometabolisme glukosa (panel kanan) pada kelompok yang diobati dengan obat (cMRI, n = 127; PET, n = 121), dibandingkan dengan kelompok plasebo (sMRI, n = 66; PET, n = 62). Voxel yang menunjukkan interaksi ini ditampilkan pada ambang batas yang tidak dikoreksi P < 0,05 (warna magenta) pada permukaan kortikal spesifik populasi. Belahan kiri dan kanan masing-masing ditampilkan di baris atas dan bawah. Wilayah otak yang menunjukkan interaksi yang tidak sesuai dengan hipotesis ditunjukkan pada Gambar 7 di Data Tambahan.
B. Jumlah total voxel di wilayah otak rentan AD yang telah ditentukan sebelumnya (total area diagram lingkaran) yang menunjukkan interaksi yang konsisten dengan hipotesis (warna magen) atau interaksi yang tidak konsisten dengan hipotesis (warna kuning) di setiap modalitas pencitraan (cMRI, panel kiri; FDG PET, panel kanan) pada ambang batas P yang semakin liberal dan tidak disesuaikan < 0,01 dan P < 0,05. Simulasi Monte Carlo menunjukkan bahwa rasio voxel yang menunjukkan efek yang konsisten dengan hipotesis versus yang tidak konsisten dengan hipotesis secara signifikan lebih tinggi dibandingkan yang diamati dari data yang dihasilkan secara acak untuk cMRI dan PET (P
LM11A-31 secara efektif mengurangi peningkatan Aβ42 dan Aβ40 di CSF dibandingkan dengan kelompok plasebo. Obat tersebut juga menunjukkan penurunan rata-rata perubahan persentase tahunan pada biomarker protein prasinaptik SNAP25 dan penurunan biomarker pascasinaptik NG, yang menunjukkan perlambatan hilangnya koneksi prasinaptik dan pascasinaptik. LM11A-31 juga mengurangi pertumbuhan YKL40, mengakibatkan penurunan skor MMSE dan peningkatan skor ADAS-Cog-13. Obat ini juga mengurangi hilangnya materi abu-abu di lobus frontal dan korteks parietal posterior serta menurunkan metabolisme glukosa di area seperti korteks entorhinal, korteks temporal, hipokampus, korteks insular, dan korteks prefrontal.
Kesimpulan
Penelitian ini menyimpulkan bahwa modulasi p75NTR oleh LM11A-31 cocok untuk uji klinis yang lebih besar. LM11A-31 memenuhi kriteria keamanan utama dan dapat ditoleransi dengan baik oleh pasien asma ringan hingga berat. Hasilnya menunjukkan perlunya penelitian lebih lanjut dengan durasi pengobatan yang lebih lama untuk mengevaluasi kelayakan penggunaan molekul kecil untuk mengatur p75NTR sebagai terapi pemodifikasi penyakit pada DA. Studi ini menemukan bahwa LM11A-31 secara signifikan mempengaruhi beberapa biomarker, termasuk Aβ40, Aβ42, SNAP25, NG, dan YKL40, yang menunjukkan pelemahan perkembangan patologis. Penelitian di masa depan dapat mengevaluasi indikator tambahan kesehatan glial.
