Publikasi baru
Protein kunci yang diidentifikasi untuk mencegah kehilangan massa tulang pada osteoporosis
Terakhir ditinjau: 02.07.2025

Semua konten iLive ditinjau secara medis atau diperiksa fakta untuk memastikan akurasi faktual sebanyak mungkin.
Kami memiliki panduan sumber yang ketat dan hanya menautkan ke situs media terkemuka, lembaga penelitian akademik, dan, jika mungkin, studi yang ditinjau secara medis oleh rekan sejawat. Perhatikan bahwa angka dalam tanda kurung ([1], [2], dll.) Adalah tautan yang dapat diklik untuk studi ini.
Jika Anda merasa salah satu konten kami tidak akurat, ketinggalan zaman, atau dipertanyakan, pilih dan tekan Ctrl + Enter.
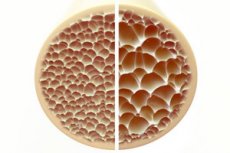
Osteoporosis, suatu kondisi yang ditandai dengan tulang yang keropos dan rapuh, menimbulkan ancaman yang signifikan terhadap kesehatan rangka. Tulang, sebagai penopang struktural utama tubuh manusia, memberikan dukungan yang vital. Ketika massa tulang menurun, hal itu tidak hanya mengganggu dukungan ini, tetapi juga mengganggu fungsi keseluruhan, yang menyebabkan penurunan kualitas hidup.
Seiring meningkatnya insiden osteoporosis pada populasi lanjut usia, beban sumber daya perawatan kesehatan untuk perawatan jangka panjang pun semakin meningkat. Oleh karena itu, penting untuk memahami mekanisme yang berkontribusi terhadap perkembangan osteoporosis dan mengembangkan perawatan yang tepat sasaran untuk meminimalkan dampak jangka panjangnya.
Osteoblas dan osteoklas adalah dua jenis sel yang memainkan peran penting dalam pemeliharaan dan pembentukan kembali jaringan tulang. Sementara osteoblas adalah sel pembentuk tulang yang bertanggung jawab atas sintesis dan pengendapan jaringan tulang baru, osteoklas adalah sel penghancur tulang yang terlibat dalam pemecahan dan pembuangan jaringan tulang lama atau rusak.
Peningkatan proporsi osteoklas menyebabkan pengeroposan tulang pada kondisi seperti osteoporosis, artritis reumatoid (radang sendi), dan metastasis tulang (kanker yang telah menyebar ke tulang). Osteoklas muncul dari diferensiasi makrofag atau monosit, yang merupakan jenis sel imun.
Dengan demikian, penghambatan diferensiasi osteoklas dapat berfungsi sebagai strategi terapeutik untuk mencegah kehilangan tulang. Akan tetapi, mekanisme molekuler yang tepat yang mengatur proses kompleks remodeling tulang masih belum jelas.
Dalam sebuah studi baru, Profesor Tadayoshi Hayata, Bapak Takuto Konno, dan Ibu Hitomi Murachi dari Universitas Sains Tokyo, bersama dengan rekan-rekannya, menyelidiki regulasi molekuler diferensiasi osteoklas. Stimulasi dengan ligan reseptor aktivator faktor nuklir kappa B (RANKL) menginduksi diferensiasi makrofag menjadi osteoklas.
Selain itu, jalur pensinyalan protein morfogenetik tulang (BMP) dan faktor pertumbuhan transformasi (TGF)-β telah terlibat dalam regulasi diferensiasi osteoklas yang dimediasi RANKL. Dalam penelitian terkini, para peneliti bertujuan untuk menyelidiki peran Ctdnep1, suatu fosfatase (enzim yang menghilangkan gugus fosfat) yang dilaporkan menekan jalur pensinyalan BMP dan TGF-β.
Studi ini dipublikasikan dalam jurnal Biochemical and Biophysical Research Communications.
Profesor Hayata menyatakan: "RANKL bertindak sebagai 'akselerator' untuk diferensiasi osteoklas. Mengemudikan mobil tidak hanya memerlukan akselerator tetapi juga rem. Di sini, kami menemukan bahwa Ctdnep1 bertindak sebagai 'rem' dalam diferensiasi osteoklas."
Para peneliti pertama-tama meneliti ekspresi Ctdnep1 pada makrofag tikus yang diobati dengan RANKL dan sel kontrol yang tidak diobati. Mereka mengamati bahwa ekspresi Ctdnep1 tidak berubah sebagai respons terhadap stimulasi RANKL. Akan tetapi, ekspresi tersebut terlokalisasi pada sitoplasma dalam bentuk granular pada makrofag dan berdiferensiasi menjadi osteoklas, berbeda dari lokalisasi perinuklear normalnya pada jenis sel lain, yang menunjukkan fungsi sitoplasmanya dalam diferensiasi osteoklas.
Lebih jauh lagi, penekanan Ctdnep1 (penurunan regulasi ekspresi gen) menghasilkan peningkatan jumlah osteoklas yang positif terhadap fosfatase asam resisten tartrat (TRAP), di mana TRAP merupakan penanda osteoklas yang berdiferensiasi.
Knockout Ctdnep1 mengakibatkan peningkatan ekspresi penanda diferensiasi utama, termasuk "Nfatc1," faktor transkripsi utama yang diinduksi oleh RANKL untuk diferensiasi osteoklas. Hasil ini mendukung "fungsi penghambat" Ctdnep1, yang dengannya ia mengatur diferensiasi osteoklas secara negatif. Selain itu, knockout Ctdnep1 juga mengakibatkan peningkatan penyerapan kalsium fosfat, yang menunjukkan peran supresif Ctdnep1 dalam resorpsi tulang.
Akhirnya, meskipun penghapusan Ctdnep1 tidak mengubah sinyal BMP dan TGF-β, sel-sel yang kekurangan Ctdnep1 menunjukkan peningkatan kadar protein terfosforilasi (teraktivasi), yang merupakan produk dari jalur sinyal RANKL. Hasil ini menunjukkan bahwa efek penghambatan Ctdnep1 pada diferensiasi osteoklas mungkin tidak dimediasi melalui sinyal BMP dan TGF-β, tetapi melalui penurunan regulasi jalur sinyal RANKL dan kadar protein Nfatc1.
Secara keseluruhan, hasil ini memberikan wawasan baru ke dalam proses diferensiasi osteoklas dan mengidentifikasi target terapi potensial yang dapat digunakan untuk mengembangkan pengobatan guna mengurangi kehilangan tulang akibat aktivitas osteoklas yang berlebihan. Selain penyakit yang ditandai dengan kehilangan tulang, Ctdnep1 juga telah diidentifikasi sebagai faktor penyebab medulloblastoma, tumor otak pada anak-anak. Para penulis optimis bahwa penelitian mereka dapat diperluas ke penyakit manusia lainnya di luar metabolisme tulang.
Profesor Hayata menyimpulkan: "Hasil penelitian kami menunjukkan bahwa Ctdnep1 diperlukan untuk mencegah osteoklastogenesis yang berlebihan. Hasil ini dapat memperluas pengetahuan kita tentang bagaimana jaringan fosforilasi-defosforilasi mengendalikan diferensiasi osteoklas dan dapat memberikan strategi terapi baru untuk pengobatan penyakit tulang yang terkait dengan aktivitas osteoklas yang berlebihan."
