Publikasi baru
Sistem pengiriman obat loop tertutup dapat meningkatkan pemberian kemoterapi
Terakhir ditinjau: 02.07.2025

Semua konten iLive ditinjau secara medis atau diperiksa fakta untuk memastikan akurasi faktual sebanyak mungkin.
Kami memiliki panduan sumber yang ketat dan hanya menautkan ke situs media terkemuka, lembaga penelitian akademik, dan, jika mungkin, studi yang ditinjau secara medis oleh rekan sejawat. Perhatikan bahwa angka dalam tanda kurung ([1], [2], dll.) Adalah tautan yang dapat diklik untuk studi ini.
Jika Anda merasa salah satu konten kami tidak akurat, ketinggalan zaman, atau dipertanyakan, pilih dan tekan Ctrl + Enter.
Ketika pasien kanker menjalani kemoterapi, dosis sebagian besar obat dihitung berdasarkan luas permukaan tubuh pasien. Hal ini diperkirakan menggunakan persamaan yang memperhitungkan tinggi dan berat pasien. Persamaan ini dirumuskan pada tahun 1916 berdasarkan data dari sembilan pasien saja.
Pendekatan dosis yang disederhanakan ini tidak memperhitungkan faktor-faktor lain dan dapat mengakibatkan pasien diberi terlalu banyak atau terlalu sedikit obat. Akibatnya, beberapa pasien mungkin mengalami toksisitas yang tidak perlu atau efektivitas yang tidak memadai dari kemoterapi yang mereka terima.
Untuk meningkatkan keakuratan dosis kemoterapi, teknisi MIT telah mengembangkan pendekatan alternatif yang memungkinkan dosis disesuaikan untuk setiap pasien. Sistem mereka mengukur jumlah obat dalam tubuh pasien dan memasukkan data tersebut ke pengontrol yang dapat menyesuaikan laju infus.
Pendekatan ini dapat membantu mengimbangi perbedaan dalam farmakokinetik obat yang disebabkan oleh komposisi tubuh, kecenderungan genetik, toksisitas organ akibat kemoterapi, interaksi dengan obat lain dan makanan, serta variasi sirkadian dalam enzim yang bertanggung jawab untuk memecah obat kemoterapi, kata para peneliti.
"Dengan menyadari kemajuan dalam memahami bagaimana obat dimetabolisme dan menerapkan alat-alat rekayasa untuk menyederhanakan dosis yang disesuaikan, kami yakin kami dapat membantu mengubah keamanan dan efektivitas banyak obat," kata Giovanni Traverso, seorang profesor madya teknik mesin di MIT, seorang ahli gastroenterologi di Brigham and Women's Hospital, dan penulis utama studi tersebut.
Louis DeRidder, seorang mahasiswa pascasarjana di MIT, adalah penulis utama makalah yang diterbitkan dalam jurnal Med.
Pemantauan berkelanjutan
Dalam penelitian ini, para peneliti berfokus pada obat yang disebut 5-fluorouracil, yang digunakan untuk mengobati kanker kolorektal dan kanker lainnya. Obat ini biasanya diberikan selama periode 46 jam, dan dosisnya ditentukan menggunakan rumus berdasarkan tinggi dan berat pasien, yang memberikan perkiraan luas permukaan tubuh.
Namun, pendekatan ini tidak memperhitungkan perbedaan komposisi tubuh yang dapat memengaruhi cara obat didistribusikan dalam tubuh, atau variasi genetik yang memengaruhi cara obat dimetabolisme. Perbedaan ini dapat menyebabkan efek samping yang berbahaya jika obat diberikan terlalu banyak. Jika obat diberikan tidak cukup, tumor mungkin tidak dapat dibunuh seperti yang diharapkan.
"Orang-orang dengan luas permukaan tubuh yang sama bisa saja memiliki tinggi dan berat badan yang sangat berbeda, massa otot yang berbeda, atau genetika yang berbeda, tetapi selama tinggi dan berat badan yang dimasukkan ke dalam persamaan tersebut menghasilkan luas permukaan tubuh yang sama, dosis yang mereka terima akan sama," kata DeRidder, seorang kandidat PhD dalam program rekayasa medis dan fisika medis di Program Ilmu Kesehatan dan Teknologi Harvard-MIT.
Faktor lain yang dapat mengubah jumlah obat dalam darah pada waktu tertentu adalah variasi sirkadian dalam enzim yang disebut dihidropirimidin dehidrogenase (DPD), yang memecah 5-fluorourasil. Ekspresi DPD, seperti banyak enzim lain dalam tubuh, diatur oleh ritme sirkadian. Dengan demikian, degradasi 5-FU oleh DPD tidak konstan, tetapi bervariasi menurut waktu. Ritme sirkadian ini dapat mengakibatkan variasi sepuluh kali lipat dalam jumlah 5-FU dalam darah pasien selama infus.
"Dengan menggunakan luas permukaan tubuh untuk menghitung dosis kemoterapi, kami mengetahui bahwa dua orang dapat memiliki toksisitas yang sangat berbeda dari 5-fluorouracil. Satu pasien dapat menjalani siklus pengobatan dengan toksisitas minimal, dan kemudian siklus dengan toksisitas yang parah. Ada sesuatu yang berubah dalam cara pasien tersebut memetabolisme kemoterapi dari satu siklus ke siklus berikutnya. Metode pemberian dosis kami yang sudah ketinggalan zaman tidak dapat menangkap perubahan ini, dan pasien menderita akibatnya," kata Douglas Rubinson, seorang onkolog klinis di Dana-Farber Cancer Institute dan penulis makalah tersebut.
Salah satu cara untuk mencoba mengimbangi variabilitas dalam farmakokinetik kemoterapi adalah strategi yang disebut pemantauan obat terapeutik, di mana pasien memberikan sampel darah di akhir satu siklus pengobatan. Setelah sampel ini dianalisis untuk mengetahui konsentrasi obat, dosis dapat disesuaikan, jika perlu, di awal siklus berikutnya (biasanya dua minggu untuk 5-fluorouracil).
Pendekatan ini telah terbukti memberikan hasil yang lebih baik bagi pasien, tetapi belum digunakan secara luas untuk kemoterapi seperti 5-fluorouracil.
Para peneliti MIT ingin mengembangkan jenis pemantauan yang serupa, tetapi dengan cara otomatis yang memungkinkan dosis obat dipersonalisasi secara real time, yang dapat memberikan hasil yang lebih baik bagi pasien.
Dalam sistem loop tertutupnya, konsentrasi obat dapat dipantau terus-menerus dan informasi ini digunakan untuk secara otomatis menyesuaikan laju infus obat kemoterapi untuk mempertahankan dosis dalam kisaran target.
Sistem loop tertutup ini memungkinkan pemberian dosis obat dipersonalisasi untuk memperhitungkan ritme sirkadian kadar enzim pemetabolisme obat, serta perubahan apa pun dalam farmakokinetik pasien sejak perawatan terakhir, seperti toksisitas organ akibat kemoterapi.
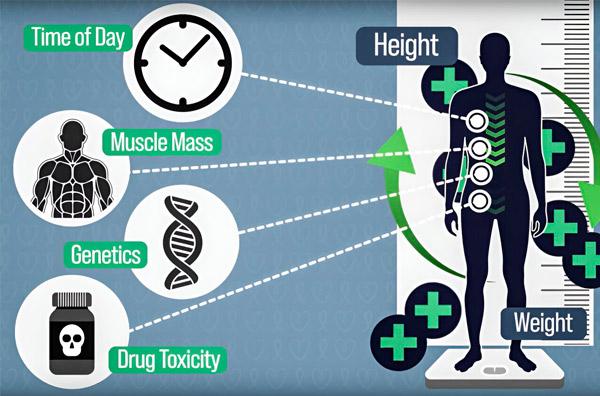
Untuk membuat dosis kemoterapi lebih tepat, teknisi MIT telah mengembangkan cara untuk terus mengukur jumlah obat dalam tubuh pasien selama infus selama beberapa jam. Ini akan membantu mengimbangi perbedaan yang disebabkan oleh komposisi tubuh, genetika, toksisitas obat, dan osilasi sirkadian. Sumber: Atas kebaikan para peneliti.
Sistem baru yang dikembangkan oleh para peneliti, yang dikenal sebagai CLAUDIA (Closed-Loop AUtomated Drug Infusion RegulAtor), menggunakan peralatan yang tersedia secara komersial untuk setiap langkah. Sampel darah diambil setiap lima menit dan segera disiapkan untuk analisis. Konsentrasi 5-fluorouracil dalam darah diukur dan dibandingkan dengan kisaran target.
Perbedaan antara konsentrasi target dan konsentrasi terukur dimasukkan ke dalam algoritma kontrol, yang kemudian menyesuaikan laju infus seperlunya untuk mempertahankan dosis dalam kisaran konsentrasi di mana obat masih efektif dan tidak beracun.
"Kami telah mengembangkan sistem yang memungkinkan kami mengukur konsentrasi obat secara terus-menerus dan menyesuaikan laju infus untuk mempertahankan konsentrasi obat dalam rentang terapi," kata DeRidder.
Penyesuaian cepat
Dalam pengujian pada hewan, para peneliti menemukan bahwa dengan menggunakan CLAUDIA mereka dapat menjaga jumlah obat yang beredar dalam tubuh dalam kisaran target sekitar 45 persen sepanjang waktu.
Kadar obat pada hewan yang diberi kemoterapi tanpa CLAUDIA tetap berada dalam kisaran target hanya 13 persen dari waktu rata-rata. Para peneliti tidak menguji efektivitas kadar obat dalam penelitian ini, tetapi mempertahankan konsentrasi dalam rentang target dianggap menghasilkan hasil yang lebih baik dan lebih sedikit toksisitas.
CLAUDIA juga mampu mempertahankan dosis 5-fluorouracil dalam kisaran target bahkan ketika obat yang menghambat enzim DPD diberikan. Pada hewan yang diberi inhibitor ini tanpa pemantauan dan penyesuaian berkelanjutan, kadar 5-fluorouracil meningkat hingga delapan kali lipat.
Untuk demonstrasi ini, para peneliti melakukan setiap langkah proses secara manual menggunakan peralatan yang tersedia di pasaran, tetapi sekarang berencana untuk mengotomatiskan setiap langkah sehingga pemantauan dan penyesuaian dosis dapat dilakukan tanpa campur tangan manusia.
Untuk mengukur konsentrasi obat, para peneliti menggunakan kromatografi cair kinerja tinggi-spektrometri massa (HPLC-MS), suatu teknik yang dapat diadaptasi untuk mendeteksi hampir semua jenis obat.
"Kami melihat masa depan di mana kami dapat menggunakan CLAUDIA untuk obat apa pun yang memiliki sifat farmakokinetik yang tepat dan dapat dideteksi oleh HPLC-MS, sehingga memungkinkan pemberian dosis yang disesuaikan untuk banyak obat yang berbeda," kata DeRidder.
