Publikasi baru
FDA menyetujui vaksin mRNA pertama untuk melawan virus syncytial pernapasan
Terakhir ditinjau: 02.07.2025

Semua konten iLive ditinjau secara medis atau diperiksa fakta untuk memastikan akurasi faktual sebanyak mungkin.
Kami memiliki panduan sumber yang ketat dan hanya menautkan ke situs media terkemuka, lembaga penelitian akademik, dan, jika mungkin, studi yang ditinjau secara medis oleh rekan sejawat. Perhatikan bahwa angka dalam tanda kurung ([1], [2], dll.) Adalah tautan yang dapat diklik untuk studi ini.
Jika Anda merasa salah satu konten kami tidak akurat, ketinggalan zaman, atau dipertanyakan, pilih dan tekan Ctrl + Enter.
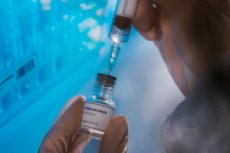
FDA telah menyetujui vaksin berbasis mRNA pertama di dunia 1345 (mRESVIA) terhadap virus sinsitial pernapasan (RSV) bagi orang berusia 60 tahun ke atas guna melindungi terhadap penyakit pernapasan bagian bawah, Moderna mengumumkan dalam siaran pers.
“Persetujuan FDA... dibangun di atas kekuatan dan fleksibilitas platform mRNA kami,” kata Stéphane Bancel, CEO Moderna, dalam siaran pers, yang mencatat bahwa ini adalah pertama kalinya vaksin mRNA disetujui untuk penyakit selain COVID-19.
Vaksin ini akan menjadi produk komersial kedua Moderna, bersama dengan vaksin mRNA melawan SARS-CoV-2 (Spikevax).
Persetujuan FDA untuk mRNA-1345 didasarkan pada hasil uji coba Fase 3 ConquerRSV. Studi tersebut melibatkan sekitar 37.000 orang dewasa berusia 60 tahun ke atas dan menemukan bahwa mRNA-1345 efektif sebesar 83,7% (95,88% CI 66%-92,2%) dalam mencegah penyakit saluran pernapasan bawah terkait RSV dengan sedikitnya dua tanda atau gejala. Vaksin tersebut sama efektifnya (82,4%) terhadap penyakit saluran pernapasan bawah dengan sedikitnya tiga tanda atau gejala (96,36% CI 34,8%-95,3%).
Reaksi merugikan sistemik lebih umum terjadi pada mereka yang menerima vaksin dibandingkan dengan kelompok plasebo (47,7% vs. 32,9%), dengan yang paling umum adalah kelelahan, sakit kepala, mialgia, dan artralgia. Efek samping serius terjadi pada 2,8% peserta di kedua kelompok. Sebagian besar reaksi bersifat ringan atau sedang dan bersifat sementara. Kurang dari 0,1% reaksi dianggap terkait dengan vaksin.
Hasil dari analisis lanjutan dari titik akhir utama studi, yang dilakukan selama peninjauan FDA, konsisten dengan analisis utama, menurut siaran pers. Analisis jangka panjang tambahan juga menunjukkan perlindungan berkelanjutan terhadap penyakit saluran pernapasan bawah terkait RSV selama tindak lanjut rata-rata 8,6 bulan.
Vaksin mRNA-1345 diharapkan tersedia di AS untuk musim virus pernapasan 2024-2025, menurut produsennya, dan akan tersedia dalam jarum suntik yang sudah diisi sebelumnya untuk meningkatkan kemudahan pemberian dan mengurangi risiko kesalahan pemberian.
Vaksin ini terdiri dari sekuens mRNA yang mengkodekan glikoprotein F pra-fusi yang distabilkan, karena glikoprotein F pra-fusi merupakan target utama untuk antibodi penetral dan sangat terkonservasi pada subtipe RSV-A dan RSV-B. Vaksin ini juga menggunakan nanopartikel lipid yang sama dengan vaksin mRNA Moderna-1273.
Pada tahun 2023, FDA menyetujui dua vaksin non-mRNA — satu dari Pfizer (Abrysvo) dan satu dari GSK (Arexvy) — yang juga dapat digunakan pada orang dewasa yang lebih tua. Vaksin Pfizer juga disetujui untuk ibu hamil guna melindungi bayi baru lahir dari virus.
