Ahli medis artikel
Publikasi baru
Keguguran karena kebiasaan - Penyebab
Terakhir ditinjau: 04.07.2025

Semua konten iLive ditinjau secara medis atau diperiksa fakta untuk memastikan akurasi faktual sebanyak mungkin.
Kami memiliki panduan sumber yang ketat dan hanya menautkan ke situs media terkemuka, lembaga penelitian akademik, dan, jika mungkin, studi yang ditinjau secara medis oleh rekan sejawat. Perhatikan bahwa angka dalam tanda kurung ([1], [2], dll.) Adalah tautan yang dapat diklik untuk studi ini.
Jika Anda merasa salah satu konten kami tidak akurat, ketinggalan zaman, atau dipertanyakan, pilih dan tekan Ctrl + Enter.
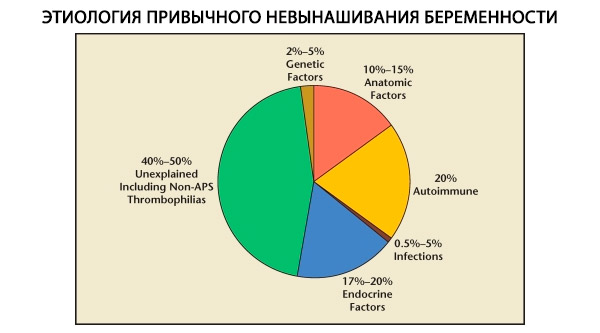
Dalam struktur keguguran berulang, faktor genetik, anatomi, endokrin, imunologi, dan infeksi dibedakan. Jika semua penyebab di atas disingkirkan, masih ada sekelompok pasien yang asal usul keguguran berulangnya tidak jelas (keguguran idiopatik). Menurut C. Coulam et al. (1996), 80% keguguran idiopatik disebabkan oleh gangguan imun yang tidak diketahui.
Tidak ada bukti yang meyakinkan bahwa endometriosis menyebabkan keguguran berulang, atau bahwa perawatan medis atau bedah endometriosis mengurangi kejadian keguguran berulang.
Menurut konsep saat ini, selain penyebab genetik dan sebagian infeksi yang menyebabkan pembentukan embrio abnormal, penerapan efek merusak dari faktor-faktor lain (anatomi, endokrin, imunologi) terdiri dari penciptaan latar belakang yang tidak menguntungkan bagi perkembangan sel telur yang dibuahi secara genetik lengkap, yang mengarah pada penipisan kapasitas cadangan korion dan penghentian perkembangan (embriogenesis). Periode kritis pada trimester pertama kehamilan dikenali sebagai 6-8 minggu (kematian embrio) dan 10-12 minggu (pengeluaran sel telur yang dibuahi).
 [ 1 ]
[ 1 ]
Penyebab genetik keguguran berulang
Faktor genetik menyumbang 3–6% penyebab keguguran berulang. Pada penghentian kehamilan sporadis pada trimester pertama, sekitar 50% aborsi memiliki kelainan kromosom. Sebagian besar (95%) adalah perubahan jumlah kromosom - monosomi (kehilangan satu kromosom), trisomi (adanya kromosom tambahan), yang merupakan akibat dari kesalahan dalam meiosis, serta poliploidi (peningkatan komposisi kromosom dengan set haploid penuh), yang terjadi ketika sel telur dibuahi oleh dua atau lebih sperma. Pada keguguran sporadis, trisomi paling sering ditemui - 60% dari semua mutasi (paling sering pada kromosom 16, serta 13, 18, 21, 22), di tempat kedua dalam frekuensi adalah sindrom Shereshevsky-Turner (kromosom 45 X0) - 20%, 15% sisanya disebabkan oleh poliploidi (terutama triploidi).
Dalam kasus perubahan jumlah kromosom pada aborsi, pemeriksaan kariotipe orang tua paling sering tidak mengungkapkan patologi apa pun dan kemungkinan penyakit kromosom janin selama kehamilan berikutnya adalah 1%. Sebaliknya, ketika memeriksa aborsi pada pasangan dengan keguguran berulang, perubahan struktural pada kromosom (intra dan interkromosom) diamati pada 3-6% kasus. Ketika memeriksa kariotipe orang tua, penataan ulang kromosom yang seimbang ditemukan pada 7% kasus. Paling sering, ini adalah translokasi resiprokal, di mana segmen satu kromosom terletak di tempat segmen lain dari kromosom non-homolog, serta mosaikisme kromosom seks, inversi dan deteksi kromosom dalam bentuk cincin. Dalam kasus adanya penataan ulang seperti itu pada salah satu pasangan, proses pemasangan dan pemisahan kromosom terhambat selama meiosis, yang mengakibatkan hilangnya (penghapusan) atau penggandaan (duplikasi) bagian kromosom dalam gamet. Hal ini mengakibatkan apa yang disebut penataan ulang kromosom yang tidak seimbang, di mana embrio tidak dapat bertahan hidup atau berfungsi sebagai pembawa patologi kromosom yang parah. Kemungkinan memiliki anak dengan kelainan kromosom yang tidak seimbang dengan adanya penataan ulang kromosom yang seimbang dalam kariotipe salah satu orang tua adalah 1–15%. Perbedaan data dikaitkan dengan sifat penataan ulang, ukuran segmen yang terlibat, jenis kelamin pembawa, dan riwayat keluarga.
Diagnostik
Anamnesis
- Penyakit keturunan pada anggota keluarga.
- Adanya kelainan kongenital dalam keluarga.
- Kelahiran anak dengan keterbelakangan mental.
- Adanya infertilitas dan/atau keguguran yang tidak diketahui penyebabnya pada pasangan suami istri atau pada kerabat.
- Adanya kasus kematian perinatal yang tidak jelas.
Metode penelitian khusus
- Studi tentang kariotipe orang tua terutama diindikasikan bagi pasangan suami istri saat kelahiran bayi baru lahir dengan cacat perkembangan, riwayat keguguran, dan juga dalam kasus keguguran kebiasaan pada tahap awal kehamilan.
- Analisis sitogenetik aborsi dalam kasus lahir mati atau kematian neonatal.
Indikasi untuk konsultasi dengan spesialis lain
Jika perubahan kariotipe terdeteksi pada orang tua, konsultasi dengan ahli genetika diperlukan untuk menilai tingkat risiko memiliki anak dengan patologi atau, jika perlu, untuk memutuskan masalah donor sel telur atau sperma.
Manajemen pasien lebih lanjut
Jika pasangan suami istri memiliki kariotipe patologis, bahkan pada salah satu orang tua, dianjurkan untuk melakukan diagnostik prenatal selama kehamilan - biopsi korionik atau amniosentesis - karena tingginya risiko gangguan perkembangan pada janin.
Penyebab anatomi keguguran berulang
Penyebab anatomi keguguran berulang meliputi:
- anomali kongenital dalam perkembangan rahim (penggandaan rahim yang lengkap; rahim bikornuata, berbentuk pelana, unikornuata; septum intrauterin sebagian atau lengkap);
- cacat anatomi yang didapat;
- perlengketan intrauterin (sindrom Asherman);
- fibroid uterus submukosa;
- insufisiensi istmik-serviks.
Frekuensi anomali anatomi pada pasien dengan keguguran berulang berkisar antara 10 hingga 16%. Frekuensi terjadinya malformasi uterus yang dapat mengakibatkan keguguran (tetapi bukan infertilitas) dalam kaitannya dengan semua malformasi uterus adalah sebagai berikut: uterus bikornuata - 37%, uterus berbentuk pelana - 15%, septum intrauterin - 22%, penggandaan uterus lengkap - 11%, uterus unikornuata - 4,4%.
Diagnosis Keguguran Habitat
Anamnesis
Pada kasus patologi anatomi rahim, penghentian kehamilan pada tahap lanjut dan kelahiran prematur lebih sering terjadi, namun dengan implantasi pada septum intrauterin atau di dekat nodus mioma, penghentian kehamilan pada tahap awal juga mungkin terjadi.
Untuk insufisiensi istmik-serviks, tanda patognomoniknya adalah penghentian kehamilan secara spontan pada trimester kedua atau kelahiran prematur dini, yang terjadi relatif cepat dan dengan sedikit rasa sakit.
Bila terjadi malformasi uterus, perlu diperhatikan indikasi anamnesis patologi saluran kemih (sering menyertai anomali kongenital uterus) dan sifat perkembangan fungsi menstruasi (indikasi hematometra dengan tanduk uterus rudimenter yang berfungsi).
Metode pemeriksaan khusus
- Saat ini, histerosalpingografi dilakukan untuk menegakkan diagnosis, yang memungkinkan mempelajari bentuk rongga rahim, mengidentifikasi keberadaan fibroid submukosa, perlengketan, septa, dan menentukan patensi tuba falopi. Untuk mendiagnosis patologi rahim, adalah rasional untuk melakukan histerosalpingografi pada periode antara menstruasi dan ovulasi, yaitu pada fase pertama siklus menstruasi setelah berhentinya keluarnya darah (hari ke-7-9 siklus). Untuk mendiagnosis insufisiensi istmik-serviks, penelitian dilakukan pada fase kedua siklus menstruasi (hari ke-18-20) untuk menentukan kondisi ostium internal serviks. Sebelum melakukan histerosalpingografi, perlu untuk menyingkirkan penyakit radang pada organ panggul atau mengobatinya.
- Histeroskopi telah meluas dalam beberapa tahun terakhir dan telah menjadi standar emas untuk mendiagnosis patologi intrauterin. Namun, karena biayanya yang lebih tinggi dibandingkan dengan histerosalpingografi, metode ini digunakan pada wanita dengan indikasi patologi intrauterin berdasarkan data USG awal. Histeroskopi dapat digunakan untuk memeriksa rongga rahim, menentukan sifat patologi intrauterin, dan, jika peralatan yang diperlukan (resektoskop) tersedia, melakukan perawatan bedah minimal invasif - pengangkatan perlengketan, nodus mioma submukosa, dan polip endometrium. Saat mengangkat septum intrauterin, preferensi diberikan pada histeroresektoskopi dengan kontrol laparoskopi, yang mencegah kemungkinan perforasi dinding rahim.
- Ultrasonografi dilakukan pada fase pertama siklus menstruasi, yang memungkinkan diagnosis dugaan mioma uterus submukosa, perlengketan intrauterin, dan pada fase kedua siklus - untuk mengidentifikasi septum intrauterin dan uterus bikornuata. Metode ini sangat penting pada tahap awal kehamilan, ketika sensitivitasnya dalam mendiagnosis kondisi ini adalah 100%, dan spesifisitasnya adalah 80%. Di luar kehamilan, diagnosis memerlukan konfirmasi tambahan dengan metode lain.
- Penulis asing menunjukkan keunggulan sonohisterografi (USG menggunakan sensor transvaginal dengan pengenalan awal larutan natrium klorida 0,9% ke dalam rongga rahim) dibandingkan histerosalpingografi, karena memungkinkan diagnosis diferensial antara septum intrauterin dan rahim bikornuata. Dengan sonohisterografi, dimungkinkan tidak hanya untuk mempelajari bentuk rongga rahim, tetapi juga untuk menentukan konfigurasi fundus korpus rahim. Di negara kita, metode ini belum tersebar luas.
- Dalam beberapa kasus yang rumit, MRI organ panggul digunakan untuk memverifikasi diagnosis. Metode ini memungkinkan untuk memperoleh informasi yang berharga jika terjadi anomali perkembangan uterus disertai dengan susunan organ yang tidak biasa di panggul. MRI penting dalam kasus tanduk uterus yang belum sempurna untuk memutuskan apakah disarankan untuk mengangkatnya. Kebutuhan untuk mengangkat tanduk uterus yang belum sempurna terjadi jika hubungannya dengan tuba dan ovarium untuk mencegah pembentukan dan perkembangan sel telur yang telah dibuahi di dalamnya. Pengakhiran kehamilan jika terjadi anomali anatomi uterus dapat dikaitkan dengan implantasi sel telur yang telah dibuahi yang tidak berhasil (pada septum intrauterin, dekat nodus mioma submukosa), vaskularisasi dan penerimaan endometrium yang tidak cukup berkembang, hubungan spasial yang dekat di rongga uterus (misalnya, dalam kasus deformasi rongga oleh nodus mioma), sering disertai dengan ICI, dan gangguan hormonal.
Pengobatan Keguguran Kebiasaan
Perawatan bedah
Jika terdapat septum intrauterin, nodus mioma submukosa, dan perlengketan, penanganan bedah yang paling efektif adalah dengan histeroresektoskopi. Frekuensi keguguran berikutnya pada kelompok wanita ini setelah penanganan adalah 10% dibandingkan dengan 90% sebelum pembedahan. Ketika membandingkan hasil metroplasti yang dilakukan dengan laparotomi dan histeroresektoskopi transservikal, P. Heinonen (1997) memperoleh hasil yang menunjukkan lebih sedikit trauma dan efektivitas histeroresektoskopi yang lebih besar; persentase kehamilan yang menghasilkan kelahiran anak yang hidup masing-masing adalah 68 dan 86%.
Operasi pengangkatan septum intrauterin, perlengketan, dan nodus mioma submukosa dapat menghilangkan keguguran pada 70–80% kasus. Namun, tindakan ini tidak efektif pada wanita dengan malformasi uterus yang melahirkan normal dengan keguguran berulang berikutnya. Kemungkinan besar dalam kasus seperti itu faktor anatomi bukanlah penyebab utama, dan perlu dicari penyebab keguguran lainnya.
Telah terbukti bahwa metroplasti abdomen dikaitkan dengan risiko infertilitas pascaoperasi yang signifikan dan tidak meningkatkan prognosis kehamilan berikutnya. Oleh karena itu, lebih baik memberikan preferensi pada operasi histeroskopi dan laparoskopi.
Perawatan Obat
Efektivitas pemasangan IUD, dosis tinggi obat estrogenik, pemasangan kateter Foley ke dalam rongga rahim setelah operasi pengangkatan perlengketan, septum intrauterin belum terbukti. Disarankan untuk merencanakan kehamilan tidak lebih awal dari 3 bulan setelah operasi. Untuk meningkatkan pertumbuhan endometrium, terapi hormonal siklik dilakukan selama 3 siklus menstruasi [14]. Selama 3 bulan dalam 14 hari pertama siklus, disarankan untuk minum obat yang mengandung 17-beta-estradiol 2 mg, dalam 14 hari berikutnya - 2 mg 17-beta-estradiol dan 20 mg didrogesteron (10 mg didrogesteron sebagai bagian dari obat kombinasi ditambah 10 mg didrogesteron dalam bentuk tablet terpisah).
Manajemen pasien lebih lanjut
Ciri-ciri perjalanan kehamilan dengan rahim bikornuata atau penggandaan rahim (bila ada 2 rongga rahim):
- pada tahap awal kehamilan, pendarahan sering terjadi dari tanduk "kosong" atau rongga rahim karena reaksi desidua yang jelas; taktik dalam kasus ini harus konservatif dan terdiri dari penggunaan agen antispasmodik dan hemostatik;
- ancaman penghentian kehamilan pada berbagai tahap;
- perkembangan insufisiensi istmik-serviks;
- retardasi pertumbuhan intrauterin akibat insufisiensi plasenta.
Pada tahap awal kehamilan, apabila terjadi pendarahan, dianjurkan istirahat di tempat tidur dan setengah istirahat, pemberian obat hemostatik, antispasmodik, dan obat penenang, serta terapi dengan gestagens (didrogesteron dalam dosis harian 20 hingga 40 mg) hingga usia kehamilan 16–18 minggu.
Penyebab endokrin dari keguguran berulang
Menurut berbagai penulis, penyebab endokrin dari keguguran mencapai 8 hingga 20%. Penyebab yang paling signifikan adalah defisiensi fase luteal (LPD), hipersekresi LH, disfungsi tiroid, dan diabetes melitus.
Penyakit tiroid yang parah atau diabetes melitus dapat menyebabkan keguguran berulang. Namun, pada diabetes melitus yang terkompensasi, risiko keguguran berulang tidak berbeda dengan populasi umum.
Pada saat yang sama, tingginya insiden hipotiroidisme pada populasi memerlukan skrining dengan pengukuran kadar TSH. Pada pasien dengan keguguran berulang, insufisiensi fase luteal diamati pada 20–60% kasus, dan tanda-tanda USG ovarium polikistik - pada 44–56%. Menurut literatur, pengaruh gangguan hormonal individu pada pembentukan kompleks gejala keguguran berulang masih kontroversial. Studi M. Ogasawara et al. (1997) tidak mengungkapkan perbedaan yang dapat diandalkan dalam frekuensi penghentian kehamilan dengan dan tanpa LPI pada pasien dengan dua atau lebih keguguran sebelumnya dalam anamnesis, tidak termasuk penyebab autoimun, anatomis, dan infeksi.
Ketidakcukupan fungsi korpus luteum dapat disebabkan oleh sejumlah faktor yang tidak menguntungkan:
- gangguan sekresi FSH dan LH pada fase pertama siklus menstruasi;
- puncak pelepasan LH yang lebih awal atau sebaliknya, terlalu lambat;
- hipoestrogenisme sebagai akibat dari folikulogenesis yang tidak memadai. Semua kondisi ini tidak dapat diperbaiki dengan terapi penggantian dengan obat gestagen pada periode pascaovulasi. Studi prospektif yang dilakukan oleh L. Regan dkk. menunjukkan peningkatan yang signifikan dalam frekuensi keguguran pada pasien dengan hipersekresi LH pada hari ke-8 siklus menstruasi dibandingkan dengan wanita dengan kadar LH darah normal (masing-masing 65% dan 12% keguguran). Efek merusak dari lonjakan LH yang tidak tepat waktu dikaitkan dengan dimulainya kembali pembelahan meiosis kedua dan ovulasi sel telur yang belum matang secara prematur, serta dengan induksi produksi androgen oleh sel-sel teka bersama dengan gangguan penerimaan endometrium di bawah pengaruh insufisiensi gestagen. Namun, pengurangan awal kadar LH praovulasi dengan agonis hormon pelepas gonadotropin tanpa tindakan tambahan yang ditujukan untuk memperpanjang kehamilan berikutnya tidak memberikan pengurangan yang diharapkan dalam frekuensi keguguran.
Standar emas untuk mendiagnosis NLF adalah pemeriksaan histologis bahan yang diperoleh dari biopsi endometrium pada fase kedua siklus selama 2 siklus menstruasi.
Diagnosis penyebab lain disfungsi ovulasi, seperti hiperprolaktinemia, hipotiroidisme, kelebihan androgen fungsional (ovarium atau adrenal), harus disertai dengan resep pengobatan yang tepat.
Diagnostik
Sejarah dan pemeriksaan fisik
- Riwayat. Faktor yang perlu dipertimbangkan: menarche terlambat, siklus menstruasi tidak teratur (oligomenore, amenore, kenaikan berat badan tiba-tiba, penurunan berat badan, infertilitas, keguguran dini yang sering terjadi).
- Pemeriksaan: tipe tubuh, tinggi badan, berat badan, hirsutisme, beratnya ciri seksual sekunder, adanya striae, pemeriksaan kelenjar susu untuk galaktorea.
- Tes diagnostik fungsional: pengukuran suhu rektal selama 3 siklus menstruasi.
Metode penelitian khusus
- Studi hormonal:
- pada fase 1 siklus menstruasi (hari ke 7–8) – penentuan kandungan FSH, LH, prolaktin, TSH, testosteron, 17-hidroksiprogesteron (17-OP), DHEAS;
- pada fase ke-2 siklus menstruasi (21–22 hari) – penentuan kandungan progesteron (indikator normatif kadar progesteron sangat bervariasi, metode ini tidak dapat digunakan tanpa memperhitungkan faktor-faktor lain).
- Ultrasonografi:
- pada fase pertama siklus menstruasi (hari ke 5–7) – diagnosis patologi endometrium, ovarium polikistik;
- pada fase ke-2 siklus menstruasi (20–21 hari) – pengukuran ketebalan endometrium (normal 10–11 mm, berkorelasi dengan kandungan progesteron).
- Biopsi endometrium untuk memverifikasi NLF dilakukan 2 hari sebelum menstruasi yang diharapkan (pada hari ke-26 dengan siklus 28 hari). Metode ini digunakan dalam kasus-kasus yang diagnosisnya tidak jelas. Untuk mempelajari perubahan endometrium dalam apa yang disebut periode "jendela implantasi", biopsi dilakukan pada hari ke-6 setelah ovulasi.
Perlakuan
Saat mendiagnosis NLF (menurut grafik suhu rektal, durasi fase ke-2 kurang dari 11 hari, peningkatan suhu bertahap diamati, transformasi sekresi endometrium yang tidak mencukupi menurut data biopsi endometrium, kadar progesteron rendah dalam serum darah), perlu untuk mengidentifikasi penyebab gangguan tersebut.
Jika NLF disertai hiperprolaktinemia, MRI otak dilakukan. Metode alternatif adalah rontgen tengkorak (daerah sella tursika).
Tahap pertama pada hiperprolaktinemia adalah menyingkirkan adenoma hipofisis, yang memerlukan perawatan bedah. Jika tidak ada perubahan signifikan, hiperprolaktinemia dianggap fungsional, dan pengobatan bromokriptin diresepkan untuk menormalkan kadar prolaktin. Dosis awal bromokriptin adalah 1,25 mg/hari selama 2 minggu, setelah memantau kadar prolaktin, jika indikator tidak normal, dosis ditingkatkan menjadi 2,5 mg/hari. Dengan peningkatan kadar prolaktin yang signifikan, dosis awal adalah 2,5 mg/hari. Jika terjadi kehamilan, bromokriptin harus dihentikan.
Jika hipotiroidisme terdeteksi, sifat patologi tiroid ditentukan bersama dengan ahli endokrinologi. Dalam kasus apa pun, terapi natrium levotiroksin harian diindikasikan, dosis dipilih secara individual hingga kadar TSH kembali normal. Jika terjadi kehamilan, pengobatan natrium levotiroksin harus dilanjutkan. Pertanyaan tentang perlu tidaknya meningkatkan dosis pada trimester pertama kehamilan diputuskan bersama dengan ahli endokrinologi setelah menerima hasil pemeriksaan hormonal (kadar TSH, tiroksin bebas).
Koreksi NLF dilakukan dengan salah satu dari dua cara. Cara pertama adalah stimulasi ovulasi, cara kedua adalah terapi penggantian dengan preparat progesteron.
Pilihan pengobatan pertama adalah stimulasi ovulasi dengan klomifen sitrat. Metode pengobatan ini didasarkan pada fakta bahwa sebagian besar gangguan fase luteal terjadi pada fase folikular siklus. Kadar progesteron yang terus berkurang pada fase ke-2 merupakan konsekuensi dari gangguan folikulogenesis pada fase ke-1 siklus. Gangguan ini akan lebih berhasil diatasi dengan dosis rendah klomifen sitrat pada fase folikular awal daripada dengan meresepkan progesteron pada fase ke-2 siklus.
Pada siklus pertama, dosis klomifen sitrat adalah 50 mg/hari mulai hari ke-5 sampai hari ke-9 siklus menstruasi. Efektivitasnya dipantau menggunakan grafik suhu rektal, pengukuran kadar progesteron pada fase ke-2 siklus, atau USG dinamis. Jika tidak ada efek yang cukup pada siklus kedua stimulasi ovulasi, dosis klomifen sitrat harus ditingkatkan menjadi 100 mg/hari mulai hari ke-5 sampai hari ke-9 siklus. Dosis maksimum yang mungkin pada siklus ketiga stimulasi ovulasi adalah 150 mg/hari. Peningkatan dosis tersebut hanya mungkin jika obat tersebut ditoleransi dengan baik (tidak ada nyeri hebat di perut bagian bawah dan punggung bagian bawah serta tidak ada tanda-tanda hiperstimulasi ovarium lainnya).
Pilihan pengobatan kedua: terapi penggantian dengan preparat progesteron, yang mendorong transformasi sekresi endometrium secara penuh, yang memberikan efek yang diperlukan pada pasien dengan keguguran berulang dengan ovulasi yang terjaga. Selain itu, dalam beberapa tahun terakhir telah ditetapkan bahwa pemberian preparat progesteron tidak hanya memiliki efek hormonal, tetapi juga efek imunomodulator, menekan reaksi penolakan dari sel imunokompeten di endometrium. Secara khusus, efek serupa telah dijelaskan untuk dihidrogesteron dengan dosis 20 mg/hari. Untuk tujuan terapi penggantian, didrogesteron digunakan dengan dosis 20 mg/hari secara oral atau progesteron yang dimikronisasi secara vaginal dengan dosis 200 mg/hari. Pengobatan dilakukan pada hari ke-2 setelah ovulasi (sehari setelah peningkatan suhu rektal) dan dilanjutkan selama 10 hari. Jika terjadi kehamilan, pengobatan dengan preparat progesteron harus dilanjutkan.
Penelitian modern belum mengonfirmasi efektivitas human chorionic gonadotropin dalam pengobatan keguguran berulang.
Dalam kasus hiperandrogenisme (genesis ovarium atau adrenal) pada pasien dengan keguguran berulang, pengobatan obat diindikasikan karena efek androgen pada kelengkapan ovulasi dan keadaan endometrium. Dalam kasus pelanggaran biosintesis androgen adrenal, efek virilisasi pada janin perempuan mungkin terjadi, oleh karena itu terapi steroid dilakukan demi kepentingan janin.
Hiperandrogenisme genesis ovarium (ovarium polikistik)
Riwayat, pemeriksaan fisik dan hasil pemeriksaan khusus
- Riwayat: menarche terlambat, gangguan siklus menstruasi seperti oligomenore (biasanya primer, lebih jarang sekunder). Kehamilan jarang terjadi, biasanya berakhir spontan pada trimester pertama, dengan periode infertilitas yang panjang di antara kehamilan.
- Pemeriksaan: hirsutisme, jerawat, stretch mark, indeks massa tubuh tinggi (opsional).
- Grafik suhu rektal: siklus anovulasi bergantian dengan siklus ovulasi dan NLF.
- Pemeriksaan hormonal: kadar testosteron tinggi, kadar FSH dan LH mungkin meningkat, rasio LH/FSH lebih besar dari 3. USG: ovarium polikistik.
Perlakuan
Perawatan non-obat
Penurunan berat badan - terapi diet, aktivitas fisik.
Perawatan Obat
- Orlistat dengan dosis 120 mg pada setiap makanan utama. Durasi pengobatan ditentukan dengan mempertimbangkan efek dan tolerabilitas.
- Pengurangan testosteron awal dengan preparat mengandung siproteron asetat (2 mg) dan EE (35 mcg) selama 3 siklus menstruasi.
- Penghentian kontrasepsi, dukungan hormonal pada fase kedua siklus (terapi gestagen) - didrogesteron dengan dosis 20 mg/hari dari hari ke-16 hingga ke-25 siklus menstruasi. Jika tidak terjadi ovulasi spontan, lanjutkan ke tahap berikutnya.
- Stimulasi ovulasi dengan klomifen sitrat dengan dosis awal 50 mg/hari dari hari ke-5 sampai hari ke-9 siklus menstruasi dengan terapi simultan dengan gestagens (didrogesteron dengan dosis 20 mg/hari dari hari ke-16 sampai hari ke-25 siklus) dan deksametason (0,5 mg).
- Jika tidak hamil, dosis klomifen sitrat ditingkatkan menjadi 100–150 mg/hari dengan pemberian gestagens pada fase kedua siklus dan deksametason (0,5 mg). Telah ditetapkan bahwa, meskipun deksametason hanya mengurangi kadar androgen adrenal, ovulasi dan konsepsi terjadi secara signifikan lebih sering dengan pengobatan dengan klomifen sitrat dan deksametason dibandingkan dengan penggunaan klomifen sitrat saja [12].
- Tiga siklus stimulasi ovulasi dilakukan, kemudian disarankan untuk menghentikan tiga siklus menstruasi dengan dukungan gestagenik dan mengambil keputusan mengenai perawatan bedah menggunakan akses laparoskopi (reseksi baji ovarium, penguapan laser).
Manajemen pasien lebih lanjut
Penatalaksanaan kehamilan harus disertai dengan dukungan gestagenik hingga usia kehamilan 16 minggu (didrogesteron dengan dosis 20 mg/hari atau progesteron termikronisasi dengan dosis 200 mg/hari), deksametason hanya diresepkan pada trimester pertama kehamilan. Pemantauan wajib dilakukan untuk diagnosis tepat waktu insufisiensi isthmus-serviks dan, jika perlu, koreksi bedahnya.
Hiperandrogenisme adrenal (sindrom adrenogenital pubertas dan pascapubertas)
Sindrom adrenogenital (AGS) adalah penyakit keturunan yang terkait dengan gangguan sintesis hormon korteks adrenal akibat kerusakan gen yang bertanggung jawab atas sintesis sejumlah sistem enzim. Penyakit ini diwariskan secara resesif autosomal dengan transmisi gen mutan dari kedua orang tua, yang merupakan pembawa yang sehat.
Dalam 90% kasus, sindrom adrenogenital disebabkan oleh mutasi pada gen CYP21B, yang menyebabkan gangguan pada sintesis 21-hidroksilase.
Riwayat, pemeriksaan fisik dan hasil pemeriksaan khusus
- Riwayat: menarche terlambat, siklus menstruasi agak memanjang, kemungkinan oligomenore, aborsi spontan pada trimester pertama, kemungkinan infertilitas.
- Pemeriksaan: jerawat, hirsutisme, tipe tubuh android (bahu lebar, panggul sempit), hipertrofi klitoris.
- Grafik suhu rektal: siklus anovulasi bergantian dengan siklus ovulasi dan NLF.
- Tes hormonal: kadar 17-OP, DHEAS tinggi.
- Ultrasonografi: ovarium tidak berubah.
Tanda patognomonik di luar kehamilan adalah peningkatan konsentrasi 17-OP dalam plasma darah.
Saat ini, tes dengan ACTH digunakan untuk mendiagnosis bentuk laten non-klasik dari hiperandrogenisme adrenal. Synacthen digunakan untuk tes ini - polipeptida sintetis yang memiliki sifat ACTH endogen, yaitu merangsang fase awal sintesis hormon steroid dari kolesterol di kelenjar adrenal.
Uji sinakten (analog ACTH): 1 ml (0,5 mg) sinakten disuntikkan secara subkutan ke bahu, kadar awal 17-OP dan kortisol pertama kali ditentukan dalam sampel plasma darah pagi hari 9 jam. Sampel darah kontrol diambil 9 jam setelah penyuntikan untuk menentukan kadar 17-OP dan kortisol. Indeks penentuan (D) kemudian dihitung menggunakan rumus:
D = 0,052 × 17-OP + 0,005 × Kortisol/17-OP - 0,018 × Kortisol/17-OP
Jika koefisien D kurang dari atau sama dengan 0,069, ini menunjukkan tidak adanya hiperandrogenisme adrenal. Jika koefisien D lebih dari 0,069, perlu dipertimbangkan bahwa hiperandrogenisme disebabkan oleh disfungsi kelenjar adrenal.
Perawatan Obat
Pengobatan utama untuk hiperandrogenisme akibat defisiensi 21-hidroksilase adalah glukokortikoid, yang digunakan untuk menekan sekresi androgen berlebih.
Manajemen pasien lebih lanjut
Karena efek virilisasi androgen ibu pada janin, dengan diagnosis hiperandrogenisme adrenal yang sudah mapan, pengobatan dengan deksametason pada dosis awal 0,25 mg diresepkan sebelum kehamilan dan dilanjutkan dengan dosis yang dipilih secara individual (dari 0,5 hingga 1 mg) selama kehamilan. Pada wanita dengan keguguran berulang yang menderita hiperandrogenisme adrenal, tidak tepat untuk membatalkan pengobatan, karena frekuensi keguguran tanpa pengobatan mencapai 14%, dengan kelanjutan - 9%.
Mengingat fakta bahwa pasien dengan sindrom adrenogenital dapat mewariskan gen ini ke janin, maka perlu dilakukan diagnostik prenatal: pada usia kehamilan 17-18 minggu, tes darah diresepkan untuk menentukan kandungan 17-OP pada ibu. Jika kadar hormon dalam darah meningkat, konsentrasinya dalam cairan ketuban ditentukan. Jika kandungan 17-OP dalam cairan ketuban meningkat, sindrom adrenogenital pada janin didiagnosis. Sayangnya, tidak mungkin untuk menentukan tingkat keparahan sindrom adrenogenital (bentuk ringan atau parah yang membuang-buang garam) berdasarkan kadar 17-OP dalam cairan ketuban. Pertanyaan tentang mempertahankan kehamilan dalam situasi ini diputuskan oleh orang tua.
Jika ayah anak adalah pembawa gen sindrom adrenogenital dan ada kasus anak yang lahir dengan sindrom ini dalam keluarga, maka pasien, bahkan tanpa hiperandrogenisme adrenal, menerima deksametason demi kepentingan janin (untuk mencegah virilisasi janin perempuan) dengan dosis 20 mcg/kg berat badan, maksimum 1,5 mg/hari dalam 2-3 dosis setelah makan. Pada minggu ke-17-18, setelah memutuskan jenis kelamin janin dan ekspresi gen sindrom adrenogenital (berdasarkan hasil amniosentesis), pengobatan dilanjutkan hingga akhir kehamilan jika janin adalah perempuan dengan sindrom adrenogenital. Jika janin adalah laki-laki atau perempuan yang bukan pembawa gen sindrom adrenogenital, deksametason dapat dihentikan.
Jika seorang wanita dengan keguguran berulang menderita hiperandrogenisme adrenal, maka pengobatan deksametason dilakukan selama kehamilan dan dihentikan hanya setelah melahirkan. Pada hari ke-3 setelah melahirkan, dosis deksametason dikurangi secara bertahap (sebesar 0,125 mg setiap 3 hari) hingga penghentian total pada periode pascapersalinan.
Hiperandrogenisme yang berasal dari campuran (ovarium dan adrenal)
Riwayat, pemeriksaan fisik dan hasil pemeriksaan khusus
- Riwayat: menarche terlambat, gangguan siklus menstruasi seperti oligomenore (biasanya primer, lebih jarang sekunder), amenore, kemungkinan cedera, gegar otak. Kehamilan jarang terjadi, biasanya berakhir spontan pada trimester pertama, periode infertilitas yang panjang di antara kehamilan.
- Pemeriksaan fisik: hirsutisme, jerawat, striae, akantosis nigrikans, indeks massa tubuh tinggi, hipertensi.
- Grafik suhu rektal: siklus anovulasi bergantian dengan siklus ovulasi dan NLF.
- Pemeriksaan hormonal: kadar testosteron tinggi, kadar FSH dan LH mungkin meningkat, rasio LH/FSH lebih besar dari 3, DHEAS tinggi, kadar 17-OP, hiperprolaktinemia mungkin ada.
- Ultrasonografi: ovarium polikistik.
- Elektroensefalografi: perubahan aktivitas biolistrik otak.
- Hiperinsulinemia, gangguan metabolisme lipid (kolesterol tinggi, lipoprotein densitas rendah dan lipoprotein densitas sangat rendah), penurunan toleransi glukosa atau peningkatan kadar glukosa darah.
Perlakuan
Perawatan non-obat
Penurunan berat badan (diet rendah kalori, aktivitas fisik).
Perawatan Obat
Tahap pertama - bila terjadi resistensi insulin, dianjurkan pemberian metformin dengan dosis harian 1000-1500 mg untuk meningkatkan sensitivitas insulin.
Tahap kedua - dalam kasus gangguan siklus menstruasi yang parah dan kadar testosteron tinggi, dianjurkan untuk meresepkan obat dengan efek antiandrogenik yang mengandung siproteron asetat (2 mg) dan etinil estradiol (35 mcg) selama 3 bulan.
Tahap ketiga adalah stimulasi ovulasi diikuti oleh dukungan gestagenik (skema dijelaskan di atas) dan mengonsumsi deksametason dengan dosis harian 0,25–0,5 mg.
Jika terjadi hiperprolaktinemia dan hipotiroidisme, koreksi obat yang tepat harus dilakukan dalam siklus stimulasi ovulasi. Jika terjadi kehamilan, bromokriptin harus dihentikan dan levotiroksin harus dilanjutkan.
Jika stimulasi ovulasi tidak efektif, pertanyaan tentang pemberian pemicu ovulasi langsung, kelayakan perawatan bedah ovarium polikistik atau fertilisasi in vitro harus diputuskan.
Manajemen pasien lebih lanjut
Pada pasien dengan sindrom metabolik, kehamilan sering kali dipersulit oleh hipertensi arteri, nefropati, hiperkoagulasi, sehubungan dengan itu perlu untuk memantau tekanan darah, hemostasiogram sejak tahap awal kehamilan dan memperbaiki gangguan yang timbul (jika perlu) dengan obat antihipertensi, agen antiplatelet dan antikoagulan. Obat gestagenik diresepkan hingga 16 minggu kehamilan - didrogesteron dengan dosis 20 mg / hari atau progesteron termikronisasi dengan dosis 200 mg / hari dalam 2 dosis.
Semua wanita dengan hiperandrogenisme merupakan kelompok risiko untuk perkembangan insufisiensi isthmus-serviks. Pemantauan kondisi serviks harus dilakukan sejak minggu ke-16 kehamilan, jika perlu - koreksi bedah insufisiensi isthmus-serviks.
Penyebab imunologis keguguran berulang
Saat ini diketahui bahwa sekitar 80% dari semua kasus keguguran berulang yang sebelumnya tidak dapat dijelaskan (setelah menyingkirkan penyebab genetik, anatomi, dan hormonal) dikaitkan dengan gangguan kekebalan tubuh. Gangguan autoimun dan aloimun dibedakan, yang menyebabkan keguguran berulang.
Dalam proses autoimun, jaringan sistem imun sendiri menjadi sasaran agresi, yaitu respons imun diarahkan terhadap antigennya sendiri. Dalam situasi ini, janin menderita secara sekunder akibat kerusakan jaringan ibu.
Pada kelainan aloimun, respons imun wanita diarahkan terhadap antigen embrio/janin yang diterima dari ayah dan berpotensi asing bagi tubuh ibu.
Gangguan autoimun yang paling sering ditemukan pada pasien dengan keguguran berulang adalah adanya autoantibodi antifosfolipid, antitiroid, dan antinuklear dalam serum. Dengan demikian, telah ditetapkan bahwa 31% wanita dengan keguguran berulang di luar kehamilan memiliki autoantibodi terhadap tiroglobulin dan peroksidase tiroid (autoantibodi tiroid mikrosomal [peroksidase tiroid]); dalam kasus ini, risiko keguguran spontan pada trimester pertama kehamilan meningkat hingga 20%. Pada keguguran berulang, adanya antibodi antinuklear dan antitiroid menunjukkan perlunya pemeriksaan lebih lanjut untuk mengidentifikasi proses autoimun dan memverifikasi diagnosis.
Sindrom antifosfolipid (APS) tetap menjadi kondisi autoimun yang diakui secara umum yang menyebabkan kematian embrio/janin.
Gangguan aloimun
Saat ini, proses aloimun yang menyebabkan penolakan janin meliputi adanya peningkatan jumlah (lebih dari 3) antigen umum dari sistem kompleks histokompatibilitas utama pada pasangan (sering diamati dalam pernikahan sedarah); rendahnya kadar faktor pemblokiran dalam serum ibu; peningkatan kadar sel pembunuh alami (sel NK CD56, CD16) dalam endometrium dan darah tepi ibu baik di luar maupun selama kehamilan; tingginya kadar konsentrasi sejumlah sitokin dalam endometrium dan serum darah, khususnya, γ-interferon, faktor nekrosis tumor a, interleukin-1 dan 2.
Saat ini, faktor aloimun yang menyebabkan keguguran dini dan cara untuk memperbaiki kondisi tersebut sedang dipelajari. Tidak ada konsensus mengenai metode terapi. Menurut beberapa peneliti, imunisasi aktif dengan limfosit donor tidak menghasilkan efek yang signifikan, sementara penulis lain menggambarkan efek positif yang signifikan dengan imunisasi dan pengobatan dengan imunoglobulin tersebut.
Saat ini, salah satu agen imunomodulator pada awal kehamilan adalah progesteron. Secara khusus, penelitian telah membuktikan peran didrogesteron dalam dosis harian 20 mg pada wanita dengan keguguran berulang pada trimester pertama kehamilan dengan peningkatan kadar sel CD56 di endometrium.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Trombofilia yang ditentukan secara genetik
Bentuk-bentuk trombofilia yang ditentukan secara genetik berikut ini dianggap sebagai kondisi trombofilik selama kehamilan yang menyebabkan keguguran berulang.
- Defisiensi antitrombin III.
- Mutasi Faktor V (mutasi Leiden).
- Kekurangan protein C.
- Kekurangan protein S.
- Mutasi gen protrombin G20210A.
- Hiperhomosisteinemia.
Pemeriksaan untuk mengidentifikasi penyebab trombofilia yang jarang diperlukan pada kasus-kasus yang terdapat:
- riwayat keluarga - tromboemboli sebelum usia 40 tahun pada kerabat;
- episode trombosis vena dan/atau arteri yang dapat diandalkan sebelum usia 40 tahun;
- trombosis berulang pada pasien dan kerabat dekat;
- komplikasi tromboemboli selama kehamilan dan setelah melahirkan saat menggunakan kontrasepsi hormonal;
- keguguran berulang, lahir mati, retardasi pertumbuhan intrauterin, solusio plasenta;
- preeklamsia dini, sindrom HELLP.
Penyebab infeksi pada keguguran berulang
Peran faktor infeksi sebagai penyebab keguguran berulang saat ini masih banyak diperdebatkan. Diketahui bahwa infeksi primer pada tahap awal kehamilan dapat menyebabkan kerusakan embrio yang tidak sesuai dengan kehidupan, yang berujung pada keguguran spontan sporadis. Namun, kemungkinan reaktivasi infeksi bersamaan dengan hasil keguguran berulang dapat diabaikan. Selain itu, mikroorganisme yang memicu keguguran berulang belum ditemukan saat ini. Penelitian dalam beberapa tahun terakhir menunjukkan bahwa sebagian besar wanita dengan keguguran berulang dan endometritis kronis memiliki prevalensi 2-3 atau lebih jenis mikroorganisme anaerob obligat dan virus di endometrium.
Menurut VM Sidelnikova dkk., pada wanita yang menderita keguguran berulang, diagnosis endometritis kronis di luar kehamilan diverifikasi secara histologis pada 73,1% kasus dan pada 86,7%, mikroorganisme oportunistik yang menetap di endometrium diamati, yang tentunya dapat menjadi penyebab aktivasi proses imunopatologis. Infeksi virus campuran yang menetap (virus herpes simpleks, Coxsackie A, Coxsackie B, enterovirus 68–71, cytomegalovirus) ditemukan pada pasien dengan keguguran berulang secara signifikan lebih sering daripada pada wanita dengan riwayat obstetrik normal. K. Kohut dkk. (1997) menunjukkan bahwa persentase perubahan inflamasi pada endometrium dan jaringan desidua pada pasien dengan keguguran berulang primer secara signifikan lebih tinggi daripada pada wanita setelah keguguran dengan riwayat setidaknya satu kelahiran cukup bulan.
Kolonisasi bakteri dan virus pada endometrium biasanya disebabkan oleh ketidakmampuan sistem imun dan kekuatan pelindung nonspesifik tubuh (sistem komplemen, fagositosis) untuk menghilangkan agen infeksi secara tuntas, dan pada saat yang sama, penyebarannya dibatasi oleh aktivasi limfosit T (pembantu T, pembunuh alami) dan makrofag. Dalam semua kasus di atas, terjadi persistensi mikroorganisme, yang ditandai dengan daya tarik fagosit mononuklear, pembunuh alami, pembantu T, yang mensintesis berbagai sitokin, ke tempat peradangan kronis. Rupanya, keadaan endometrium seperti itu mencegah terciptanya imunosupresi lokal pada periode praimplantasi, yang diperlukan untuk membentuk penghalang pelindung dan mencegah penolakan janin setengah asing.
Terkait hal ini, sebelum hamil, wanita yang sering keguguran harus didiagnosis menderita endometritis kronis. Untuk menegakkan atau menyingkirkan diagnosis ini, biopsi endometrium dilakukan pada hari ke-7-8 siklus menstruasi disertai pemeriksaan histologis, PCR, dan pemeriksaan bakteriologis bahan dari rongga rahim. Saat memastikan diagnosis, endometritis kronis diobati sesuai dengan standar pengobatan penyakit radang organ panggul.

