Ahli medis artikel
Publikasi baru
Obat-obatan
Neuroleptik, atau antipsikotik
Terakhir ditinjau: 04.07.2025

Semua konten iLive ditinjau secara medis atau diperiksa fakta untuk memastikan akurasi faktual sebanyak mungkin.
Kami memiliki panduan sumber yang ketat dan hanya menautkan ke situs media terkemuka, lembaga penelitian akademik, dan, jika mungkin, studi yang ditinjau secara medis oleh rekan sejawat. Perhatikan bahwa angka dalam tanda kurung ([1], [2], dll.) Adalah tautan yang dapat diklik untuk studi ini.
Jika Anda merasa salah satu konten kami tidak akurat, ketinggalan zaman, atau dipertanyakan, pilih dan tekan Ctrl + Enter.
Antipsikotik (neuroleptik) adalah golongan obat psikotropika yang utamanya digunakan untuk mengobati skizofrenia. Saat ini, umum untuk membedakan dua kelompok (atau kategori) obat: antipsikotik tipikal dan atipikal. Berikut ini adalah informasi tentang sifat farmakologis, indikasi penggunaan, dan efek samping terapi untuk masing-masing kelompok obat ini.
Indikasi penggunaan antipsikotik tipikal
Saat ini, indikasi utama untuk meresepkan neuroleptik tradisional, menurut rekomendasi yang diberikan oleh peneliti terkemuka di bidang psikofarmaka, meliputi hal berikut.
- Meredakan agitasi psikomotor dan gangguan perilaku yang disebabkan oleh gejala psikotik berat. Dalam kasus ini, penggunaan obat oral atau parenteral dengan aksi antipsikotik diindikasikan, baik global (clopromazine, levomepromazine, thioproperazine, zuclopenthixol) maupun selektif - dalam bentuk efek pada gangguan halusinasi-paranoid (haloperidol, trifluoperazine).
- Terapi anti-relaps (pencegahan). Untuk tujuan ini, obat-obatan bentuk depo diresepkan, terutama pada pasien dengan kepatuhan obat yang buruk (haloperidol decanoate, flupentixol bentuk yang diperpanjang), atau obat-obatan dosis kecil atau sedang untuk mendapatkan efek disinhibitor (antinegatif), dari antara obat-obatan tersebut, yang dosis tingginya digunakan untuk meredakan gangguan psikotik akut (flupentixol, zuclopenthixol). Dalam jenis terapi ini, juga dianjurkan untuk meresepkan apa yang disebut neuroleptik kecil (thioridazine, chlorprothixene, sulpiride), yang aktivitas psikotropikanya terdiri dari efek pada manifestasi kutub depresi dan gangguan insomnia.
- Mengatasi resistensi terapeutik terhadap antipsikotik atipikal dalam pengobatan kondisi psikotik akut. Untuk tujuan ini, bentuk parenteral antipsikotik tradisional dengan aksi antipsikotik global (klorpromazin, levomepromazin, dll.) dan selektif (haloperidol) biasanya digunakan.
Obat-obatan ini menimbulkan berbagai efek samping, yang sifatnya bergantung pada ciri-ciri profil farmakologis masing-masing obat. Antipsikotik dengan efek kolinolitik yang lebih nyata lebih sering menimbulkan gangguan akomodasi, konstipasi, mulut kering, dan retensi urin. Efek sedatif lebih khas pada antipsikotik dengan efek antihistamin yang nyata, dan hipotensi ortostatik lebih khas pada obat-obatan yang memblokir reseptor a1-adrenergik. Blokade transmisi kolinergik, nordrenergik, dan dopaminergik oleh neuroleptik tipikal dapat menyebabkan sejumlah gangguan pada bidang seksual, seperti amenore atau dismenore, anorgasmia, galaktorea, pembengkakan dan nyeri pada kelenjar susu, dan penurunan potensi. Efek samping pada bidang seksual terutama terkait dengan sifat kolinolitik dan adrenoblokator obat-obatan ini, dan juga dengan peningkatan sekresi prolaktin karena blokade metabolisme dopamin. Efek samping paling serius dari neuroleptik tipikal adalah disfungsi motorik. Efek samping tersebut merupakan alasan paling umum bagi pasien untuk berhenti minum obat. Tiga efek samping utama terapi yang dikaitkan dengan pengaruh pada bidang motorik meliputi sindrom ekstrapiramidal dini, diskinesia tardif, dan NMS.
Sindrom ekstrapiramidal diyakini terkait dengan blokade reseptor D2 di ganglia basal. Sindrom ini meliputi distonia, parkinsonisme neuroleptik, dan akatisia. Manifestasi reaksi distonik akut (diskinesia dini) meliputi hiperkinesis yang berkembang tiba-tiba, krisis okulogirik, kontraksi otot-otot wajah dan badan, opistotonus. Gangguan ini bergantung pada dosis dan sering terjadi setelah 2-5 hari terapi dengan neuroleptik yang sangat kuat seperti haloperidol dan fluphenazine. Untuk meredakan diskinesia dini, dosis neuroleptik dikurangi dan obat antikolinergik (biperiden, trihexyphenidyl) diresepkan. Diskinesia tardif biasanya melibatkan otot-otot leher dan, tidak seperti reaksi distonik akut, kurang responsif terhadap pengobatan dengan antikolinergik. Parkinsonisme neuroleptik ditandai dengan penurunan keterampilan motorik spontan, hipo- dan amimia, tremor saat istirahat, dan kekakuan. Penting untuk membedakan gejala-gejala ini dari gangguan negatif yang tampak serupa pada skizofrenia, yang diwakili oleh keterasingan emosional, penumpulan afek, dan anergia. Untuk memperbaiki efek samping ini, penggunaan antikolinergik, pengurangan dosis neuroleptik, atau penggantiannya dengan antipsikotik atipikal diindikasikan. Akatisia dimanifestasikan oleh kecemasan internal, ketidakmampuan untuk tetap berada di satu tempat untuk waktu yang lama, dan kebutuhan untuk terus-menerus menggerakkan lengan atau kaki. Untuk meredakannya, antikolinergik dan beta-blocker sentral (propranolol) digunakan.
Diskinesia lanjut dimanifestasikan oleh gerakan tak sadar dari kelompok otot mana pun, paling sering otot lidah dan mulut. Secara klinis, sejumlah bentuknya dibedakan: diskinesia otot pipi, lidah, mulut (kontraksi berkala otot pengunyahan, menciptakan kesan orang yang meringis, lidah dapat menjulur keluar dari mulut pasien tanpa sadar); distonia tardif dan akatisia tardif; (pasien membuat gerakan koreoatetoid pada kepala, badan, tungkai atas dan bawah). Bentuk gangguan ini tercatat terutama selama pengobatan jangka panjang dengan neuroleptik tradisional dan terdeteksi pada sekitar 15-20% pasien yang meminumnya sebagai terapi pemeliharaan. Mungkin, pada beberapa pasien risiko mengembangkan gejala diskinesia meningkat, karena beberapa di antaranya diamati di klinik skizofrenia bahkan sebelum "era neuroleptik". Selain itu, diskinesia tardif telah dideskripsikan pada wanita lanjut usia dan pasien dengan gangguan afektif. Diskinesia tardif diduga terkait dengan peningkatan jumlah reseptor dopamin di striatum, meskipun sistem GABAergik dan neurotransmitter lainnya juga mungkin terlibat dalam patogenesisnya. Tidak ada pengobatan universal yang efektif untuk efek samping tersebut. Disarankan bahwa dosis rendah neuroleptik berkekuatan tinggi dengan aksi pemblokiran dopamin atau vitamin E mungkin memiliki efek menguntungkan sedang pada gangguan ini. Tindakan yang paling efektif untuk diskinesia tardif adalah pengurangan dosis neuroleptik tipikal atau penggantiannya dengan antipsikotik atipikal.
Menurut data terkini, sindrom neuroleptik ganas terjadi pada sekitar 0,5% kasus psikofarmaka. Mungkin, jarangnya komplikasi yang mengancam jiwa seperti itu saat ini dapat dijelaskan oleh meluasnya penggunaan antipsikotik atipikal dalam praktik, karena risiko terjadinya NMS selama pengobatan dengan obat-obatan ini tidak signifikan. Secara umum diterima bahwa penyebab utama terjadinya NMS adalah blokade berlebihan sistem dopaminergik selama terapi dengan neuroleptik, terutama setelah meningkatkan dosis antipsikotik yang sangat kuat. Gejala utama NMS adalah hipertermia, peningkatan tonus otot rangka dan refleks tendon, gangguan kesadaran dengan transisi ke koma. Tes darah menunjukkan leukositosis, peningkatan laju sedimentasi eritrosit, aktivitas transaminase hati; tes urin menunjukkan adanya albuminuria. Gangguan keseimbangan air dan elektrolit terjadi dengan cepat, yang menciptakan prasyarat untuk pembentukan edema serebral. NMS adalah kondisi akut yang memerlukan rawat inap pasien yang mendesak untuk terapi infus intensif. Dalam pengobatan NMS, hidrasi dan terapi simtomatik adalah yang terpenting. Dalam situasi ini, semua neuroleptik yang diresepkan harus segera dihentikan. Dalam beberapa kasus, agonis reseptor dopamin (misalnya, bromokriptin) atau pelemas otot memiliki efek positif, meskipun efektivitasnya belum diteliti. Setelah NMS dihilangkan, neuroleptik tidak boleh dilanjutkan setidaknya selama dua minggu. Selanjutnya, antipsikotik dengan potensi rendah dapat diresepkan, sebaiknya obat generasi baru. Dosis obat yang baru diresepkan harus ditingkatkan dengan sangat hati-hati, dengan memantau kondisi fungsi vital dan data laboratorium (tes darah dan urine).
Neuroleptik tipikal jarang menimbulkan komplikasi fatal yang berbahaya. Manifestasi overdosis terutama terkait dengan profil individual dari aksi antiadrenergik dan antikolinergik obat tersebut. Karena obat-obatan ini memiliki efek antiemetik yang kuat, lavage lambung diindikasikan untuk eliminasinya dari tubuh, daripada pemberian emetik. Hipotensi arteri, sebagai suatu peraturan, merupakan konsekuensi dari blokade reseptor adrenergik, dan harus dikoreksi dengan pemberian dopamin dan norepinefrin. Dalam kasus aritmia jantung, penggunaan lidokain diindikasikan.
Mekanisme kerja dan efek farmakologis antipsikotik tipikal
Seiring berkembangnya psikofarmakologi, berbagai pilihan untuk efek antipsikotik pada neuroreseptor diajukan. Hipotesis utamanya tetap bahwa obat ini memengaruhi neurostruktur dopamin (terutama reseptor D2), berdasarkan data tentang gangguan metabolisme dopamin normal dalam struktur otak pada psikosis. Reseptor dopamin D2 terletak di ganglia basal, nukleus akumbens, dan korteks frontal; mereka memainkan peran utama dalam mengatur aliran informasi antara korteks serebral dan talamus.
Gambar tersebut menunjukkan pemahaman yang lebih rinci tentang gangguan dalam transmisi dopamin di area kortikal dan subkortikal otak dan peran gangguan ini dalam perkembangan gejala skizofrenia (diadaptasi dari monografi oleh Jones RB, Buckley PF, 2006).
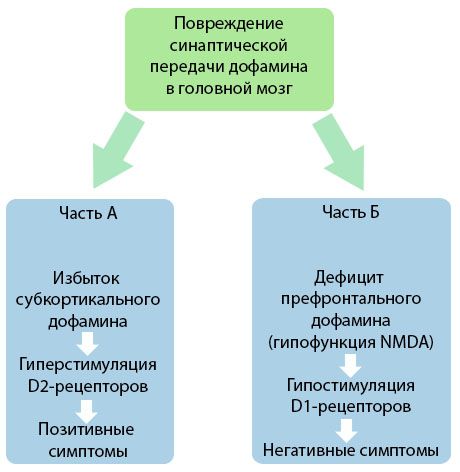
Bagian A mencerminkan teori dopamin klasik dan awal, yang mendalilkan kelebihan dopamin di area subkortikal dan hiperstimulasi reseptor D2, yang menyebabkan munculnya gejala produktif. Bagian B menunjukkan modernisasi teori berikutnya pada awal 1990-an. Data yang diperoleh saat ini mengungkapkan bahwa kekurangan dopamin pada reseptor D, bersama dengan stimulasi yang tidak memadai pada reseptor ini di korteks prefrontal, menyebabkan munculnya gejala negatif dan defisit kognitif. Oleh karena itu, menurut pemahaman modern, kedua jenis gangguan transmisi dopaminergik - kelebihan dopamin subkortikal dan kekurangannya di korteks prefrontal - merupakan hasil gabungan dari gangguan transmisi sinaptik di area prefrontal dan dikaitkan dengan hipofungsi N-metil-N-aspartat. Selain dopamin yang awalnya terisolasi, neurotransmiter lain yang terlibat dalam patogenesis skizofrenia kemudian diidentifikasi, seperti serotonin, asam gamma-aminobutirat, glutamat, norepinefrin, asetilkolin, dan berbagai neuropeptida. Meskipun peran mediator ini belum sepenuhnya dipelajari, namun seiring berkembangnya pengetahuan, menjadi jelas bahwa manifestasi berbagai pergeseran neurokimia dalam tubuh. Oleh karena itu, efek klinis obat antipsikotik merupakan penjumlahan efek pada berbagai pembentukan reseptor dan mengarah pada penghapusan gangguan homeostasis.
Dalam beberapa tahun terakhir, karena munculnya metode penelitian baru seperti pengikatan ligan radioisotop dan pemindaian PET, kemajuan signifikan telah dicapai dalam menjelaskan mekanisme biokimia yang tepat dari tindakan neuroleptik. Secara khusus, kekuatan komparatif dan tropisme obat untuk mengikat neuroreseptor individu di berbagai area dan struktur otak telah ditentukan. Ketergantungan langsung dari tingkat keparahan efek antipsikotik suatu obat pada kekuatan efek pemblokirannya pada berbagai reseptor dopaminergik telah ditunjukkan. Baru-baru ini, empat jenis reseptor tersebut telah diidentifikasi:
- D1 terletak terutama di area substantia nigra dan striatum (yang disebut wilayah nigrostriatal), serta wilayah prefrontal;
- D2 - di daerah nigrostriatal, mesolimbik dan kelenjar pituitari anterior (sekresi prolaktin);
- D3 (presinaptik) - dalam berbagai struktur otak, mengontrol aktivitas dopaminergik sesuai hukum umpan balik negatif;
- D4 (presinaptik) - terutama di daerah nigrostriatal dan mesolimbik.
Pada saat yang sama, kini dapat dianggap terbukti bahwa blokade reseptor D2-lah yang menyebabkan perkembangan antipsikotik, efek sedatif sekunder, serta efek samping ekstrapiramidal. Manifestasi klinis lain dari blokade reseptor jenis ini adalah efek analgesik dan antiemetik dari neuroleptik (pengurangan mual, muntah akibat penekanan pusat muntah), serta penurunan kandungan hormon pertumbuhan dan peningkatan produksi prolaktin (efek samping neuroendokrin, termasuk galaktorea dan ketidakteraturan menstruasi). Blokade jangka panjang reseptor D2 nigrostriatal menyebabkan munculnya hipersensitivitasnya, yang bertanggung jawab atas perkembangan diskinesia tardif dan "psikosis hipersensitivitas". Manifestasi klinis yang mungkin terjadi dari blokade reseptor D3 dan D4 presinaptik terutama terkait dengan efek stimulasi neuroleptik. Karena blokade parsial reseptor ini di area nigrostriatal dan mesolimbokortikal, neuroleptik pengaktif dan tajam (kuat, sangat aktif) dalam dosis kecil dapat merangsang, dan dalam dosis tinggi menekan, transmisi dopaminergik.
Dalam beberapa tahun terakhir, minat terhadap fungsi sistem serotonergik otak, termasuk reseptor serotonin, telah meningkat tajam. Faktanya adalah bahwa di berbagai bagian otak, sistem serotonergik memiliki efek modulasi pada struktur dopaminergik. Secara khusus, di wilayah mesokortikal, serotonin menghambat pelepasan dopamin, dan karenanya, blokade reseptor 5-HT postsinaptik menyebabkan peningkatan kandungan dopamin. Seperti diketahui, perkembangan gejala negatif pada skizofrenia dikaitkan dengan hipofungsi neuron dopamin dalam struktur prefrontal korteks serebral. Saat ini, sekitar 15 jenis reseptor 5-HT sentral diketahui. Telah ditemukan secara eksperimental bahwa neuroleptik mengikat terutama pada reseptor 5-HT dari tiga jenis pertama.
Obat-obatan ini memiliki efek yang terutama merangsang (agonis) pada reseptor 5-HT1a. Konsekuensi klinis yang mungkin terjadi: peningkatan aktivitas antipsikotik, penurunan keparahan gangguan kognitif, perbaikan gejala negatif, efek antidepresan, dan penurunan kejadian efek samping ekstrapiramidal.
Efek neuroleptik pada reseptor 5-HT2, terutama pada subtipe 5-HT2a, sangat penting. Reseptor ini terutama terletak di korteks serebral dan sensitivitasnya meningkat pada pasien skizofrenia. Kemampuan neuroleptik generasi baru untuk mengurangi keparahan gejala negatif, meningkatkan fungsi kognitif, mengatur tidur dengan meningkatkan durasi total tahap tidur gelombang lambat (gelombang D), mengurangi agresivitas, dan meringankan gejala depresi serta sakit kepala seperti migrain (yang timbul akibat gangguan serebrovaskular) dikaitkan dengan blokade reseptor 5-HT2a. Di sisi lain, dengan blokade reseptor 5-HT2a, efek hipotensi dan gangguan ejakulasi pada pria mungkin terjadi.
Dipercayai bahwa efek neuroleptik pada reseptor 5-HT2c menyebabkan efek sedatif (ansiolitik), peningkatan nafsu makan (disertai peningkatan berat badan) dan penurunan produksi prolaktin.
Reseptor 5-HT3 terutama terletak di daerah limbik, dan bila terblokir, efek antiemetik timbul terlebih dahulu, kemudian efek antipsikotik dan ansiolitik juga meningkat.
Terjadinya gejala seperti parkinsonisme juga bergantung pada daya penghambatan obat terhadap reseptor kolinergik muskarinik. Efek kolinolitik dan penghambatan dopamin sampai batas tertentu saling berhubungan. Diketahui, misalnya, bahwa di daerah nigrostriatal reseptor D2 menghambat pelepasan asetilkolin. Ketika lebih dari 75% reseptor D2 di daerah nigrostriatal diblokir, keseimbangan terganggu demi sistem kolinergik. Inilah alasan efek korektif obat antikolinergik (korektor) pada efek samping ekstrapiramidal neuroleptik. Klorprotiksen, klozapin, dan olanzapin memiliki afinitas tinggi terhadap reseptor muskarinik dan praktis tidak menyebabkan efek samping ekstrapiramidal, karena mereka memblokir reseptor kolinergik dan dopaminergik secara bersamaan. Turunan haloperidol dan piperazin fenotiazin memiliki efek yang jelas pada reseptor dopamin, tetapi memiliki efek yang sangat lemah pada reseptor kolin. Hal ini disebabkan oleh kemampuan mereka untuk menyebabkan efek samping ekstrapiramidal yang nyata, yang berkurang ketika dosis yang sangat tinggi digunakan, ketika efek kolinolitik menjadi nyata. Selain mengurangi efek pemblokiran dopamin pada reseptor D2 di daerah nigrostriatal dan meratakan efek samping ekstrapiramidal, efek kolinergik yang kuat dapat menyebabkan penurunan fungsi kognitif, termasuk gangguan memori, serta efek samping perifer (selaput lendir kering, gangguan akomodasi visual, sembelit, retensi urin, kebingungan, dll.). Neuroleptik memiliki efek pemblokiran yang cukup kuat pada reseptor histamin tipe I, yang pertama-tama dikaitkan dengan tingkat keparahan efek sedatif, serta peningkatan berat badan karena peningkatan nafsu makan. Efek antialergi dan antipruritus dari neuroleptik juga dikaitkan dengan sifat antihistaminnya.
Selain efek penghambatan dopamin, antiserotonergik, kolinolitik, dan antihistamin, sebagian besar neuroleptik memiliki sifat adrenolitik, yaitu menghambat reseptor a1-adrenergik sentral dan perifer. Adrenoblocker seperti klorpromazin dan klorprotiksen memiliki efek sedatif yang nyata. Selain itu, efek penghambatan obat-obatan ini dapat menyebabkan efek samping neurovegetatif (hipotensi arteri, takikardia, dll.), serta peningkatan efek hipotensi dari adrenoblocker.
Karya sejumlah besar penulis menyediakan data tentang kekuatan ikatan (afinitas) neuroleptik individu dengan berbagai jenis neuroreseptor.
Berdasarkan profil neurokimia aksinya, antipsikotik tipikal dan atipikal, di antara yang paling banyak digunakan dalam praktik klinis, secara kondisional dapat dibagi menjadi enam kelompok.
Kelompok pertama terdiri dari penghambat selektif reseptor D2 dan D4 (sulpiride, amisudpride, haloperidol, dll.) dari kelompok turunan benzamida dan butirofenon. Dalam dosis kecil, terutama karena blokade reseptor D4 presinaptik, mereka mengaktifkan transmisi impuls saraf dopaminergik dan memiliki efek stimulasi (disinhibitori), dalam dosis besar mereka memblokir reseptor D2 di semua area otak, yang secara klinis dimanifestasikan oleh efek antipsikotik yang nyata, serta efek samping ekstrapiramidal dan endokrin (karena prolaktinemia).
Kelompok kedua mencakup penghambat reseptor D2 yang sangat aktif, serta obat-obatan yang secara lemah atau sedang memblokir reseptor 5-HT2a dan 5-HT1a (flupentiksol, flufenazin, zuclopentiksol, dll.), yaitu terutama turunan piperazin dari fenotiazin atau tioksanten yang dekat dengannya dalam struktur stereokimia. Seperti obat-obatan dari kelompok pertama, neuroleptik ini, pertama-tama, memiliki efek antipsikotik (insisivatif) yang nyata, dan juga menyebabkan efek piye ekstrapiramidal dan prolaktinemia. Dalam dosis kecil, mereka memiliki efek pengaktifan (psikostimulasi) yang cukup.
Kelompok ketiga terdiri dari neuroleptik sedatif polivalen yang memblokir sebagian besar neuroreseptor dengan cara yang tidak berdiferensiasi. Obat-obatan ini memiliki efek pemblokiran yang jelas pada reseptor dopamin dan juga menyebabkan efek adrenolitik dan kolinolitik yang kuat. Ini termasuk sebagian besar neuroleptik sedatif, terutama turunan alifatik dan piperidin dari fenotiazin, serta tioksanten yang dekat dengannya dalam struktur stereokimia (klorpromazin, levomepromazin, klorprotiksen, dll.). Spektrum aktivitas psikotropika obat-obatan ini didominasi, pertama-tama, oleh efek sedatif primer yang jelas, yang berkembang terlepas dari dosis yang digunakan, dan efek antipsikotik sedang. Selain itu, karena efek antikolinergiknya yang jelas, obat-obatan dari kelompok ini menyebabkan efek samping ekstrapiramidal dan neuroendokrin yang lemah atau sedang, tetapi sering kali menyebabkan perkembangan hipotensi ortostatik dan reaksi otonom lainnya karena blokade reseptor a1-adrenergik yang jelas.
Kelompok keempat mencakup neuroleptik yang memblokir reseptor D2 dan 5-HT2a secara seimbang, yaitu pada tingkat yang sama (yang terakhir pada tingkat yang sedikit lebih besar) dan reseptor a1-adrenergik pada tingkat sedang. Kelompok ini mencakup perwakilan dari generasi baru antipsikotik atipikal (risperidone, ziprasidone, sertindole), yang memiliki struktur kimia yang berbeda. Mekanisme kerja neurokimia menentukan pengaruh selektifnya terutama pada area mesolimbik dan mesokortikal otak. Seiring dengan efek antipsikotik yang berbeda, tidak adanya atau ekspresi lemah efek samping ekstrapiramidal (bila menggunakan dosis terapeutik), prolaktinemia lemah atau sedang dan sifat adrenolitik sedang (reaksi hipotensi), kelompok neuroleptik ini mampu memperbaiki gejala negatif dengan stimulasi tidak langsung transmisi dopaminergik di korteks serebral.
Kelompok kelima terdiri dari antipsikotik atipikal polivalen dari trisiklik dibenzodiazepin atau struktur serupa (clozapine, olanzapine dan quetiapine). Sama seperti obat-obatan dari kelompok ketiga, mereka memblokir sebagian besar neuroreseptor dengan cara yang tidak berdiferensiasi. Namun, reseptor 5-HT2a diblokir lebih kuat daripada reseptor D2 dan D4, terutama yang terletak di daerah nigrostriatal. Ini menentukan tidak adanya atau efek ekstrapiramidal yang lemah dan tidak adanya efek samping neuroendokrin yang terkait dengan peningkatan produksi prolaktin dengan efek antipsikotik yang jelas dan kemampuan untuk mengurangi keparahan gejala negatif. Selain itu, semua obat dari kelompok ini memiliki sifat adrenolitik dan antihistamin yang jelas, yang menentukan efek sedatif dan hipotensi. Clozapine dan olanzapine juga memiliki efek pemblokiran yang cukup jelas pada reseptor muskarinik dan menyebabkan perkembangan efek samping kolinolitik.
Dengan demikian, kemampuan untuk memblokir reseptor dopaminergik postsinaptik dengan peningkatan kompensasi dalam sintesis dan metabolisme dopamin adalah satu-satunya sifat biokimia umum untuk semua neuroleptik yang dipertimbangkan dalam kelompok ini.
Kelompok keenam mencakup satu-satunya antipsikotik atipikal, aripiprazole, yang muncul di pasar psikofarmakologis domestik relatif baru-baru ini. Obat ini merupakan agonis parsial reseptor D2-dopamin, dan bertindak sebagai antagonis fungsional dalam keadaan hiperdopaminergik dan sebagai agonis fungsional dalam profil hipodopaminergik. Profil reseptor aripiprazole yang unik memungkinkan untuk mengurangi risiko gangguan ekstrapiramidal dan hiperprolaktinemia saat menggunakannya. Selain itu, aripiprazole bertindak sebagai agonis parsial reseptor 5-HT1a dan pada saat yang sama merupakan antagonis reseptor 5-HT2a. Diasumsikan bahwa interaksi dengan reseptor tersebut mengarah pada fungsi sistem serotonin dan dopamin yang umumnya seimbang, sehingga mekanisme kerja aripiprazole dapat ditetapkan sebagai menstabilkan sistem dopamin-serotonin.
Dengan demikian, tingkat pengetahuan terkini tentang mekanisme kerja neurokimia neuroleptik memungkinkan kita untuk mengusulkan klasifikasi farmakodinamik baru yang lebih kuat secara patogenetik dari kelompok obat psikotropika ini. Penggunaan klasifikasi ini memungkinkan kita untuk memprediksi spektrum aktivitas psikotropika, toleransi, dan kemungkinan interaksi obat dari obat tertentu secara luas. Dengan kata lain, fitur aktivitas neurokimia suatu obat sangat menentukan fitur aktivitas klinisnya, yang harus digunakan saat memilih obat antipsikotik tertentu untuk pasien tertentu.
Efektivitas efek antipsikotik global dari setiap neuroleptik diperkirakan menggunakan apa yang disebut ekuivalen klorpromazin, yang diambil sebagai 1. Misalnya, ekuivalen klorpromazin dari haloperidol = 50. Ini berarti bahwa efektivitas antipsikotik dari 1 mg haloperidol sebanding dengan 50 mg klorpromazin. Berdasarkan indikator ini, telah dikembangkan klasifikasi yang menyediakan alokasi neuroleptik dengan aktivitas antipsikotik tinggi (ekuivalen klorpromazin> 10,0), sedang (ekuivalen klorpromazin = 1,0-10,0) dan rendah (ekuivalen klorpromazin = 1,0), yang disebut patentitas. Neuroleptik tipikal (antipsikotik generasi pertama) telah banyak digunakan dalam psikofarmaka klinis selama hampir setengah abad. Spektrum aktivitas terapeutiknya meliputi:
- tindakan antipsikotik global dalam bentuk kemampuan untuk mengurangi berbagai manifestasi psikosis secara merata dan berbeda:
- efek sedatif (penghambatan) primer - kemampuan obat untuk dengan cepat meredakan agitasi psikomotorik;
- selektif, tindakan antipsikotik selektif, terwujud dalam kemampuan untuk memengaruhi gejala individu: delirium, halusinasi, hilangnya dorongan, dll.;
- mengaktifkan (disinhibitori, disinhibitori, antiautis) tindakan neurotropik, yang dimanifestasikan oleh perkembangan gejala ekstrapiramidal;
- tindakan somatotropik dalam bentuk pengembangan efek samping neuroendokrin dan vegetatif;
- efek depresan, yang dinyatakan dalam kemampuan beberapa antipsikotik untuk menimbulkan gejala depresi.
Efektivitas antipsikotik generasi pertama dalam pengobatan tidak hanya gangguan psikotik, tetapi juga gangguan dalam psikiatri ambang telah terbukti berkali-kali dan tidak dapat disangkal. Oleh karena itu, meskipun frekuensi efek samping terapi yang tinggi saat diresepkan, obat ini terus digunakan dalam praktik medis.
Antipsikotik atipikal
Pedoman modern berisi data tentang keuntungan penggunaan antipsikotik generasi kedua dalam farmakoterapi. Istilah "atipikal" (sinonim - antipsikotik generasi kedua) bersifat kondisional dan digunakan terutama untuk kemudahan penunjukan generasi baru. Dibandingkan dengan neuroleptik tradisional, obat-obatan dari kelompok ini lebih efektif dalam mengoreksi gangguan negatif, afektif, dan kognitif, yang dikombinasikan dengan tolerabilitas yang lebih baik dan risiko gejala ekstrapiramidal yang lebih rendah. Perbedaan dalam sifat efek terapeutik satu atau beberapa obat dari serangkaian antipsikotik atipikal dijelaskan, seperti dalam kelompok neuroleptik tipikal, oleh profil tindakan farmakologisnya masing-masing.
Untuk memperjelas kemungkinan psikofarmaka dengan antipsikotik atipikal, disarankan untuk fokus pada obat-obatan kelompok ini yang terdaftar di Rusia.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Klozapin (dibenzodiazepin)
Pendiri kelompok antipsikotik atipikal. Mekanisme kerja clozapine ditandai dengan blokade ringan reseptor D2 dengan antagonisme tinggi simultan terhadap reseptor 5-HT2a, reseptor a1, a2-adrenergik dan H1-histamin. Telah terbukti sebagai antipsikotik yang efektif dalam kasus resistensi terhadap antipsikotik lain (obat dari kelompok cadangan), dan juga diindikasikan untuk pengobatan mania kronis, agitasi psikotik, agresi. Dalam praktik rumah tangga, clozapine sering diresepkan untuk mencapai sedasi dan sebagai hipnotik pada pasien psikotik. Harus diakui bahwa penggunaan clozapine tersebut tidak sesuai dengan profil indikasi utamanya untuk digunakan dalam terapi. Mungkin, sikap terhadap antipsikotik ini sebagai obat dengan kepentingan sekunder harus direvisi, karena saat ini merupakan satu-satunya obat dengan efektivitas yang terbukti pada pasien yang resistan.
Tidak seperti neuroleptik pada umumnya, klozapin tidak menyebabkan gangguan ekstrapiramidal yang serius karena afinitasnya yang rendah terhadap reseptor O2. Ternyata obat ini juga dapat digunakan untuk mengobati distonia lanjut dan akatisia berat. Karena risiko terkena NMS yang rendah, klozapin dapat dianggap sebagai obat pilihan pada pasien yang sebelumnya menderita komplikasi ini.
Namun, sejumlah efek samping serius dapat terjadi selama terapi clozapine. Yang paling berbahaya di antaranya (bahkan ketika dosis kecil diresepkan) adalah agranulositosis, yang terjadi pada 0,5-1,0% pasien. Efek samping penting lainnya yang dapat terjadi saat menggunakan obat ini termasuk kantuk, hipersalivasi, dan penambahan berat badan, yang seringkali sudah meningkat pada saat clozapine diresepkan di bawah pengaruh terapi antipsikotik sebelumnya. Perhatian juga harus diberikan pada kemungkinan terjadinya takikardia, hipotensi arteri, dan kejang epilepsi saat meminumnya. Kemungkinan kejang tergantung pada dosisnya. Risikonya meningkat secara signifikan jika dosis clozapine melebihi 600 mg/hari. Terjadinya kejang bukanlah kontraindikasi untuk penggunaan obat lebih lanjut, tetapi memerlukan pengurangan dosis hingga setengahnya dan resep antikonvulsan, seperti asam valproat. Pencegahan efek samping pengobatan clozapine meliputi pemantauan cermat jumlah sel darah putih, serta parameter EKG dan endokrin.
Overdosis klozapin dapat menyebabkan depresi kesadaran hingga koma, serta gejala yang terkait dengan efek kolinolitik (takikardia, delirium), kejang epilepsi, depresi pernapasan, sindrom ekstrapiramidal. Kematian dapat terjadi jika mengonsumsi obat dengan dosis lebih dari 2500 mg.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Risperidon
Turunan benzisoxazole dengan afinitas tinggi terhadap reseptor serotonin dan dopamin Dj dengan efek dominan pada sistem serotonin. Obat ini memiliki berbagai indikasi untuk digunakan, termasuk meredakan eksaserbasi, pengobatan anti-relaps, terapi untuk episode psikotik pertama, dan perbaikan gejala negatif skizofrenia. Obat ini telah terbukti meningkatkan fungsi kognitif pada pasien dengan skizofrenia. Data awal telah diperoleh bahwa risperidone juga mengurangi gejala afektif komorbid pada pasien dengan skizofrenia dan dapat menjadi obat pilihan dalam pengobatan gangguan afektif bipolar.
Efek samping terapi risperidone, terutama gangguan ekstrapiramidal, bergantung pada dosis dan lebih sering terjadi pada dosis yang melebihi 6 mg/hari. Efek samping lainnya termasuk mual, muntah, kecemasan, kantuk, dan peningkatan kadar prolaktin serum. Penggunaan risperidone jangka panjang dapat menyebabkan penambahan berat badan dan perkembangan diabetes melitus tipe 2, tetapi dengan kemungkinan yang lebih rendah dibandingkan dengan clozapine, olanzapine.
Overdosis dapat menyebabkan kantuk, kejang epilepsi, perpanjangan interval QT dan pelebaran kompleks QRS, serta hipotensi arteri. Telah dilaporkan kasus kematian akibat overdosis risperidone.
Keunggulan obat yang tidak diragukan lagi adalah tersedianya bentuk cair dan cepat larut (sublingual), yang penggunaannya mempercepat masuknya obat ke dalam tubuh pasien dan memudahkan kontrol atas asupannya. Ada juga bentuk obat yang diperpanjang - bubuk untuk persiapan suspensi untuk pemberian intramuskular (konsta-risperidon dalam mikrosfer). Direkomendasikan untuk perawatan pemeliharaan pasien dengan skizofrenia, terutama untuk pasien dengan kepatuhan yang buruk. Perlu diperhitungkan fakta bahwa obat tersebut membutuhkan waktu sekitar tiga minggu untuk memasuki aliran darah, oleh karena itu, ketika memulai terapi dengan konsta-risperidon, pasien juga harus mengonsumsi risperidon bentuk oral setidaknya selama 3 minggu setelah suntikan pertama.
Olanzapin
Dalam hal tindakan farmakologis, obat ini mirip dengan clozapine, karena memiliki profil reseptor pleiomorfik dengan afinitas yang signifikan terhadap reseptor serotonin, muskarinik, a1-adrenergik, dan histamin. Aktivitas terapeutik olanzapine memiliki fitur yang mirip dengan efektivitas clozapine dan risperidone dalam hal dampak pada gejala positif, negatif, dan depresi skizofrenia. Pada saat yang sama, data telah diperoleh tentang efektivitas olanzapine yang lebih besar dibandingkan dengan antipsikotik atipikal lainnya pada pasien dengan episode psikotik pertama dan dalam koreksi indikator fungsi kognitif. Perlu diperhatikan bahwa pada awal terapi menggunakan bentuk tablet obat, efek disinhibisi yang cepat dapat muncul dengan peningkatan agitasi psikomotor dan kecemasan. Oleh karena itu, dalam pengobatan serangan yang disertai dengan agitasi psikomotor yang parah, penggunaan bentuk suntikan obat diindikasikan.
Olanzapine jarang menyebabkan gangguan ekstrapiramidal atau tardive dyskinesia, dan efek samping yang paling umum dengan penggunaannya adalah gangguan metabolik dan penambahan berat badan. Telah ditetapkan bahwa pasien yang menerima olanzapine cukup sering mengalami peningkatan kadar kolesterol, lipid plasma, dan kecenderungan diabetes melitus tipe 2, tetapi efek tersebut sama-sama umum terjadi pada pasien yang menerima olanzapine dan clozapine. Pada saat yang sama, data telah diperoleh yang menunjukkan bahwa penambahan berat badan berkorelasi dengan respons positif terhadap olanzapine (yaitu berfungsi sebagai indikator prognosis terapi yang penting), dan berkembang menjadi obesitas hanya pada 20-30% pasien yang mengalami penambahan berat badan berlebih selama pengobatan.
Overdosis dapat menyebabkan sedasi, efek antikolinergik toksik, kejang epilepsi, dan hipotensi arteri. Saat ini belum ada data yang meyakinkan untuk menilai risiko kematian akibat overdosis.
Quetiapin
Obat ini tergolong senyawa dibenzothiazepine. Profil reseptornya sebagian besar mirip dengan clozapine. Tingkat pengikatan quetiapine ke reseptor D2 rendah (kurang dari 50%) dan jangka pendek bahkan ketika dosis tinggi digunakan. Obat ini efektif dalam pengobatan gejala positif, negatif dan umum skizofrenia. Ada bukti keberhasilan penggunaannya baik dalam kasus resistensi tinggi terhadap terapi dan untuk meningkatkan fungsi kognitif pasien, yang memberikan hak untuk merekomendasikannya sebagai antipsikotik lini pertama untuk terapi pemeliharaan skizofrenia. Terakhir, quetiapine memiliki efek antidepresan dan pengaktifan sedang. Oleh karena itu, obat ini diindikasikan dalam pengobatan serangan depresi-delusi dan gangguan lingkaran senesto-hipokondriakal.
Aktivitas timotropik tinggi yang telah terbukti dari quetiapine menjelaskan fakta bahwa quetiapine terdaftar sebagai sarana untuk meredakan dan mencegah gangguan depresi. Untuk pengobatan episode manik dalam gangguan bipolar tipe I dan II, quetiapine digunakan sebagai sarana tambahan. Tidak adanya bentuk suntikan agak membatasi penggunaannya pada pasien dengan agitasi dan perilaku agresif.
Quetiapine ditoleransi dengan baik, obat ini praktis tidak menyebabkan sindrom ekstrapiramidal, kecuali dalam kasus di mana dosis maksimum digunakan. Quetiapine tidak menyebabkan hiperprolaktinemia, lebih jarang daripada olanzapine dan clozapine, obat ini menyebabkan penambahan berat badan dan gangguan toleransi glukosa.
Ziprasidon
Memiliki profil aktivitas reseptor yang unik. Sebagai antagonis poten reseptor 5HT2a dan reseptor D2, obat ini juga merupakan penghambat aktif penyerapan kembali serotonin dan norepinefrin. Studi klinis telah menunjukkan keunggulan signifikan ziprasidone dalam efeknya terhadap gejala psikotik dan manifestasi agresi dibandingkan dengan haloperidol. Ada juga data tentang efek positif ziprasidone terhadap fungsi kognitif pasien dengan skizofrenia, serta pada gejala afektif komorbid, indikator fungsi sosial. Ziprasidone biasanya ditoleransi dengan baik dan sangat jarang menyebabkan sindrom ekstrapiramidal, penambahan berat badan, dan gangguan metabolik. Lebih sering terjadi perpanjangan interval QT lebih dari 460 ms, oleh karena itu, disarankan bagi pasien yang menerima obat ini untuk menjalani pemeriksaan EKG sebelum meresepkan obat dan pemantauan kontrol selama pengobatan. Perhatian khusus harus diberikan pada terapi bersamaan (mengonsumsi obat antiaritmia), yang dapat memperburuk perpanjangan interval QT dan menyebabkan perkembangan aritmia jantung, fibrilasi ventrikel.
Sertindol
Termasuk dalam turunan fenilidol. Obat ini memiliki antagonisme fungsional yang tinggi terhadap reseptor D2, serotonin (terutama reseptor 5-HT2a), dan reseptor a1-adrenergik. Menurut studi elektroneurokimia, sertindole secara selektif menghambat reseptor dopamin di daerah segmental ventral. Selektivitas tersebut, kemungkinan besar, memastikan risiko rendah sindrom ekstrapiramidal dan hiperprolaktinemia saat menggunakan obat tersebut. Hasil studi perbandingan menunjukkan bahwa sertindole sebanding dengan haloperidol dalam hal aktivitas antipsikotik. Obat ini memiliki efek disinhibisi yang nyata pada pasien dengan gejala negatif dan depresi, yang lebih unggul daripada efek serupa rispolept. Ada juga bukti yang mengonfirmasi efektivitas sertindole untuk koreksi gangguan kognitif pada pasien dengan skizofrenia. Sertindole secara umum ditoleransi dengan baik oleh pasien, jarang menyebabkan sedasi dan oleh karena itu direkomendasikan sebagai obat pengganti ketika efek samping terjadi selama terapi dengan antipsikotik modern lainnya.
Efek samping yang serius termasuk kemampuan obat untuk memperpanjang interval QT, yang dapat menyebabkan aritmia jantung. Ketika menganalisis studi pasca pemasaran, menjadi jelas bahwa profil jantung sertindole tidak berbeda dari antipsikotik generasi baru lainnya.
Aripiprazol
Obat ini memiliki aktivitas antipsikotik yang sebanding dengan obat atipikal lainnya, tetapi memiliki efek yang lebih besar pada parameter fungsi kognitif pasien dengan skizofrenia. Tindakan farmakologis unik yang disebutkan di atas dari obat tersebut - agonis parsial reseptor D2 - memungkinkan untuk mengurangi risiko sindrom ekstrapiramidal dan hiperprolaktinemia saat menggunakannya.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Amisulprida
Termasuk dalam golongan benzamida tersubstitusi. Obat ini secara selektif mengikat subtipe reseptor dopaminergik D2 dan D3, tidak memiliki afinitas terhadap subtipe D1, D4 dan D5, serta terhadap reseptor serotonin, H1-histamin, a1-adrenergik dan kolinergik. Bila digunakan dalam dosis tinggi, obat ini memblokir reseptor D2 postsinaptik. Dalam dosis rendah, efek disinhibisinya terwujud karena blokade reseptor D2 presinaptik, D3, yang karenanya penggunaannya juga efektif dalam pengobatan gejala negatif, meskipun bukan antagonis gabungan reseptor D2 dan reseptor serotonin. Hasil sejumlah penelitian menunjukkan aktivitas antipsikotik obat yang nyata bila digunakan dalam dosis tinggi, yang lebih unggul daripada obat tradisional.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
Efek samping terapi antipsikotik
Tabel berikut mencantumkan efek samping utama terapi antipsikotik atipikal.
Persiapan |
|
Gangguan konduksi pada EKG |
Gangguan metabolisme (peningkatan berat badan, peningkatan kadar glukosa, kolesterol, trigliserida dalam darah) |
||
Klozapin |
. |
Bahasa Indonesia: ++ |
Bahasa Indonesia: ++ |
++- |
|
Risperidon |
Bahasa Indonesia: ++ |
+/- |
Bahasa Indonesia: ++ |
+/- |
|
Olanzapin |
+ |
+/- |
+++ |
Bahasa Indonesia: ++ |
+++ |
Quetiapin |
+/- |
+ |
+/- |
--- |
|
Ziprasidon |
+ |
Bahasa Indonesia: ++ |
+/- |
+/- |
+/- |
Sertindol |
Bahasa Indonesia: ++ |
-- |
+/- |
-- |
|
Ariliprazol |
-- |
--- |
+/- |
-- |
-- |
Amisulprida |
Bahasa Indonesia: ++ |
+/- |
|||
Catatan. Tingkat keparahan efek samping: "+++" - tinggi; "++" - rata-rata; "+" - rendah; "+/-" - diragukan; "-" - tidak ada.
Sindrom ekstrapiramidal
Salah satu ciri utama antipsikotik atipikal, berbeda dengan antipsikotik tradisional, adalah kemampuannya yang rendah untuk menimbulkan sindrom ekstrapiramidal, yang menjadi terobosan dalam farmakoterapi pemeliharaan skizofrenia. Namun, seperti yang dapat dilihat dari data dalam tabel, saat menggunakan obat-obatan individual dari seri ini (risperidone, amisulpride), gejala-gejala tersebut dapat terjadi, yang memerlukan perhatian khusus saat meresepkannya.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Kelainan EKG
Kemungkinan timbulnya efek samping jantung merupakan masalah serius saat menggunakan beberapa antipsikotik modern dalam terapi. Dalam kasus ini, kita berbicara tentang perpanjangan interval QT, yang dapat menyebabkan perkembangan aritmia. Gangguan konduksi, terutama perpanjangan interval QT, paling sering diamati selama pengobatan dengan clozapine, sertindole, ziprasidone. Patologi bersamaan dalam bentuk bradikardia, blok atrioventrikular, hipotiroidisme dapat berkontribusi pada terjadinya komplikasi ini selama terapi dengan obat-obatan yang disebutkan di atas. Saat ini, pemantauan EKG direkomendasikan sekitar sekali setiap 3 bulan pada pasien yang menerima terapi pemeliharaan dengan antipsikotik atipikal.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Gangguan endokrin
Saat ini, perhatian terbesar disebabkan oleh kemampuan obat antipsikotik atipikal untuk menyebabkan penambahan berat badan. Peningkatan berat badan, kadar glukosa dan trigliserida dalam darah dapat menyebabkan gangguan metabolisme dan perkembangan diabetes tipe 2. Kehati-hatian khusus dan pemantauan mingguan parameter biokimia diperlukan selama terapi dengan clozapine dan olanzapine. Menurut J. Geddes et al. (2000), PB Jones, PF Buckley (2006), harus diakui sebagai hal yang tepat untuk melakukan pemeriksaan menyeluruh terhadap pasien sebelum meresepkan mereka antipsikotik tertentu dari generasi modern, karena diketahui bahwa gangguan metabolisme lebih sering terjadi pada pasien yang memiliki kecenderungan turun-temurun, berat badan berlebih, gangguan spektrum lipid dan hiperglikemia sebelum dimulainya pengobatan. Algoritma pemantauan yang diusulkan oleh PB Jones, PF Buckley (2006) mencakup beberapa poin.
- Kumpulan riwayat medis dan faktor keluarga mengenai risiko gangguan metabolisme.
- Pendaftaran indeks massa tubuh, EKG, tekanan darah dan denyut nadi sebelum dimulainya perawatan.
- Pengumpulan data laboratorium (glukosa, profil lipid, kolesterol) sebelum memulai terapi.
- Pemantauan rutin indeks massa tubuh dan tanda-tanda vital selama perawatan.
- Memantau data laboratorium selama perawatan.
Terjadinya hiperprolaktinemia selama terapi antipsikotik disebabkan oleh blokade sentral reseptor dopamin di hipotalamus, yang menyebabkan pelepasan prolaktin dari kelenjar pituitari anterior. Hiperprolaktinemia paling sering terjadi dengan pengobatan olanzapine, risperidone, dan amisulpride.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Agranulositosis
Komplikasi serius lain dari terapi antipsikotik. Komplikasi ini dapat diamati selama pengobatan dengan clozapine dan olanzapine. Menurut J. Geddes et al. (2000), komplikasi ini didiagnosis selama 3 bulan pertama pada 1-2% pasien yang mengonsumsi obat ini. Dalam hal ini, tes darah mingguan direkomendasikan untuk pasien yang mengonsumsi obat ini selama 18 minggu pertama terapi dan pemantauan bulanan setelahnya. Telah ditunjukkan bahwa ketika dosis neuroleptik yang disebutkan di atas dikurangi, tes darah klinis kembali normal. Pada saat yang sama, harus diakui bahwa hingga saat ini tidak ada strategi yang jelas untuk pasien yang mengalami efek samping yang disebutkan di atas yang terkait dengan gangguan metabolik. Paling sering, satu antipsikotik atipikal diganti dengan yang lain. Arah lain yang menjanjikan adalah penunjukan terapi korektif khusus, khususnya penggunaan bromokriptin untuk mengoreksi hiperprolaktinemia. Situasi yang ideal adalah situasi di mana perawatan pasien dengan gangguan tersebut dilakukan dengan keterlibatan berkala dari dokter spesialis penyakit dalam, khususnya ahli endokrinologi, ahli jantung, dan spesialis lainnya.
Sebagai kesimpulan, perlu dicatat bahwa jika algoritma yang diberikan untuk meresepkan dan memantau tidak hanya kondisi mental tetapi juga fisik pasien diikuti, penggunaan obat generasi kedua lebih aman daripada neuroleptik biasa.
Sejumlah antipsikotik lain saat ini sedang dalam tahap pengembangan. Obat generasi berikutnya kemungkinan akan memiliki mekanisme kerja yang berbeda (misalnya, profil GABAergik) dan akan mampu memengaruhi berbagai manifestasi skizofrenia, termasuk gangguan defisit yang sebenarnya.
Perhatian!
Untuk menyederhanakan persepsi informasi, instruksi ini untuk penggunaan obat "Neuroleptik, atau antipsikotik " diterjemahkan dan disajikan dalam bentuk khusus berdasarkan instruksi resmi untuk penggunaan medis obat tersebut. Sebelum digunakan baca anotasi yang datang langsung ke obat.
Deskripsi disediakan untuk tujuan informasi dan bukan panduan untuk penyembuhan diri. Kebutuhan akan obat ini, tujuan dari rejimen pengobatan, metode dan dosis obat ditentukan sendiri oleh dokter yang merawat. Pengobatan sendiri berbahaya bagi kesehatan Anda.

