Ahli medis artikel
Publikasi baru
Human immunodeficiency virus (HIV)
Terakhir ditinjau: 04.07.2025

Semua konten iLive ditinjau secara medis atau diperiksa fakta untuk memastikan akurasi faktual sebanyak mungkin.
Kami memiliki panduan sumber yang ketat dan hanya menautkan ke situs media terkemuka, lembaga penelitian akademik, dan, jika mungkin, studi yang ditinjau secara medis oleh rekan sejawat. Perhatikan bahwa angka dalam tanda kurung ([1], [2], dll.) Adalah tautan yang dapat diklik untuk studi ini.
Jika Anda merasa salah satu konten kami tidak akurat, ketinggalan zaman, atau dipertanyakan, pilih dan tekan Ctrl + Enter.
Acquired Immune Deficiency Syndrome diidentifikasi sebagai penyakit khusus pada tahun 1981 di Amerika Serikat, ketika sejumlah anak muda menderita penyakit serius yang disebabkan oleh mikroorganisme yang tidak patogen atau patogen lemah bagi orang sehat. Sebuah studi tentang status kekebalan pasien mengungkapkan penurunan tajam dalam jumlah limfosit secara umum dan T-helper secara khusus. Kondisi ini disebut AIDS (Acquired Immune Deficiency Syndrome). Metode infeksi (kontak seksual, melalui darah dan sediaannya) menunjukkan sifat penyakit yang menular.
Agen penyebab AIDS ditemukan pada tahun 1983 secara independen oleh orang Prancis L. Montagnier, yang menyebutnya LAV Lymphoadenopathy Associated Virus, karena ia menemukannya pada pasien dengan limfadenopati; dan orang Amerika R. Gallo, yang menyebut virus tersebut HTLV-III (Human T-lymphotropic Virus III): ia sebelumnya telah menemukan virus limfotropik I dan II.
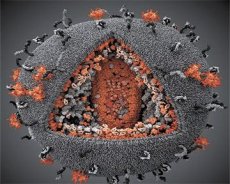
Perbandingan sifat-sifat virus LAV dan HTLV-III menunjukkan identitasnya, sehingga untuk menghindari kebingungan, virus tersebut diberi nama HIV (Human Immunodeficiency Virus, atau HIV) pada tahun 1986. HIV berbentuk bulat, dengan diameter 110 nm. Selubung virus berbentuk polihedron, tersusun atas 12 segi lima dan 20 segi enam. Di bagian tengah dan sudut-sudut setiap segi enam terdapat molekul protein glikosilasi gpl20 (angka 120 menunjukkan berat molekul protein dalam kilodalton). Sebanyak 72 molekul gpl20 terletak pada permukaan virion dalam bentuk duri-duri aneh, yang masing-masing terkait dengan protein intramembran gp41. Protein-protein ini, bersama dengan lapisan lipid ganda, membentuk superkapsid (membran) virion.
Protein gpl20 dan gp41 dibentuk dengan memotong protein prekursor Env oleh protease seluler. Protein gp41 membentuk "batang" spike dengan mengikat domain sitoplasmiknya ke protein matriks p17MA yang terletak tepat di bawah amplop. Molekul p17 berinteraksi selama pematangan virion untuk membentuk ikosahedron di bawah amplop.
Di bagian tengah virion, protein p24 membentuk kapsid berbentuk kerucut. Bagian kapsid yang menyempit terhubung ke membran virion dengan partisipasi protein rb. Di dalam kapsid, terdapat dua molekul RNA genomik virus yang identik. Keduanya terhubung dengan ujung 5' ke protein nukleokapsid p7NC. Protein ini menarik karena memiliki dua residu asam amino (motif) yang kaya akan sistein dan histidin serta mengandung atom Zn - keduanya disebut "jari-jari seng" karena keduanya menangkap molekul RNA genomik untuk dimasukkan ke dalam virion yang terbentuk. Kapsid juga mengandung tiga enzim. Revertase (RT), atau kompleks pol, meliputi reverse transcriptase, RNase H, dan DNA polimerase yang bergantung pada DNA. Revertase hadir sebagai heterodimer p66/p51. Protease (PR) - p10, memulai dan melaksanakan proses pematangan virion. Integrase (IN) - p31, atau endonuklease, memastikan masuknya DNA provirus ke dalam genom sel inang. Kapsid juga mengandung molekul RNA primer (tRNAl"3).
Genom RNA dalam sel diubah menjadi genom DNA (DNA provirus) dengan bantuan enzim reverse transcriptase, yang terdiri dari 9283 pasangan nukleotida. Genom ini dibatasi di sebelah kiri dan kanan oleh apa yang disebut pengulangan terminal panjang, atau LTR: S'-LTR di sebelah kiri dan 3'-LTR di sebelah kanan. LTR masing-masing mengandung 638 pasangan nukleotida.
Genom HIV terdiri dari 9 gen, beberapa di antaranya saling tumpang tindih di ujungnya (memiliki beberapa kerangka baca) dan memiliki struktur eksonintron. Genom ini mengendalikan sintesis 9 protein struktural dan 6 protein pengatur.
Pentingnya LTR bagi genom virus adalah karena LTR mengandung elemen pengatur berikut yang mengendalikan fungsinya:
- sinyal transkripsi (wilayah promoter);
- sinyal penambahan poli-A;
- sinyal pembatasan;
- sinyal integrasi;
- sinyal regulasi positif (TAR untuk protein TAT);
- elemen pengatur negatif (NRE untuk protein NEF);
- tempat untuk pelekatan primer RNA (tRNA™3) untuk sintesis DNA untai minus pada ujung 3'; sinyal pada ujung 5' LTR yang berfungsi sebagai primer untuk sintesis DNA untai plus.
Selain itu, LTR mengandung unsur-unsur yang terlibat dalam regulasi penyambungan mRNA, pengemasan molekul vRNA ke dalam kapsid (unsur Psi). Akhirnya, selama transkripsi genom, dua sinyal terbentuk dalam mRNA panjang untuk protein REV, yang mengubah sintesis protein: CAR - untuk protein pengatur dan CRS - untuk protein struktural. Jika protein REV mengikat CAR, protein struktural disintesis; jika tidak ada, hanya protein pengatur yang disintesis.
Gen-gen pengatur dan protein-protein berikut memainkan peran yang sangat penting dalam mengatur fungsi genom virus:
- Protein TAT, yang melakukan kontrol positif terhadap replikasi virus dan bekerja melalui wilayah pengatur TAR;
- Protein NEV dan VPU, yang melakukan kontrol negatif replikasi melalui wilayah NRE;
- Protein REV, yang melakukan kontrol positif-negatif. Protein REV mengontrol kerja gen gag, pol, env dan melakukan regulasi negatif penyambungan.
Dengan demikian, replikasi HIV berada di bawah kendali tiga faktor - positif, negatif, dan positif-negatif.
Protein VIF menentukan daya infeksi virus yang baru disintesis. Protein ini dikaitkan dengan protein kapsid p24 dan hadir dalam virion dalam jumlah 60 molekul. Protein NEF diwakili dalam virion oleh sejumlah kecil molekul (5-10), mungkin terkait dengan selubung.
Protein VPR menghambat siklus sel pada fase G2, berpartisipasi dalam pengangkutan kompleks preintegrasi ke dalam inti sel, mengaktifkan beberapa gen virus dan sel, serta meningkatkan efisiensi replikasi virus dalam monosit dan makrofag. Lokasi protein VPR, TAT, REV, dan VPU dalam virion belum ditetapkan.
Selain proteinnya sendiri, membran virion mungkin mengandung beberapa protein sel inang. Protein VPU dan VPR berperan dalam pengaturan reproduksi virus.
Varian antigenik dari human immunodeficiency virus (HIV)
Virus imunodefisiensi manusia (HIV) sangat bervariasi. Bahkan dari tubuh satu pasien, strain virus dapat diisolasi yang berbeda secara signifikan dalam sifat antigenik. Variabilitas tersebut difasilitasi oleh penghancuran intensif sel CD4+ dan respons antibodi yang kuat terhadap infeksi HIV. Bentuk baru HIV, HIV-2, secara biologis dekat dengan HIV-1 tetapi secara imunologis berbeda darinya, telah diisolasi dari pasien dari Afrika Barat. Homologi struktur primer genom virus ini adalah 42%. DNA provirus HIV-2 mengandung 9671 bp, dan LTR-nya - 854 bp. HIV-2 kemudian diisolasi di wilayah lain di dunia. Tidak ada kekebalan silang antara HIV-1 dan HIV-2. Dua bentuk besar HIV-1 diketahui: O (Outlier) dan M (Mayor), yang terakhir dibagi menjadi 10 subtipe (AJ). Delapan subtipe (AH) beredar di Rusia.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Mekanisme interaksi HIV dengan sel
Setelah menembus tubuh, virus pertama-tama menyerang sel yang mengandung reseptor CD4 yang khusus untuknya. Reseptor ini terdapat dalam jumlah besar pada sel T-helper, dalam jumlah yang lebih sedikit pada makrofag dan monosit, dan sel T-helper sangat sensitif terhadap virus.
Human immunodeficiency virus (HIV) mengenali reseptor CD4 menggunakan protein gpl20-nya. Proses interaksi HIV dengan sel terjadi menurut skema berikut: penyerapan yang dimediasi reseptor -> lubang berlapis -> vesikel berlapis -> lisosom. Di dalamnya, membran virion menyatu dengan membran lisosom, dan nukleokapsid, yang terbebas dari superkapsid, memasuki sitoplasma; dalam perjalanan menuju nukleus, nukleokapsid dihancurkan, dan RNA genomik serta komponen inti terkait dilepaskan. Kemudian, reverse transcriptase mensintesis untai minus DNA pada RNA virion, kemudian RNase H menghancurkan RNA virion, dan DNA polimerase virus mensintesis untai plus DNA. 5'-LTR dan 3'-LTR terbentuk di ujung provirus DNA. Provirus DNA dapat tetap berada di nukleus untuk beberapa waktu dalam bentuk tidak aktif, tetapi cepat atau lambat ia terintegrasi ke dalam kromosom sel target dengan bantuan integrase-nya. Di dalamnya, provirus tetap tidak aktif sampai limfosit T yang diberikan diaktifkan oleh antigen mikroba atau sel imunokompeten lainnya. Aktivasi transkripsi DNA seluler diatur oleh faktor nuklir khusus (NF-kB). Ini adalah protein pengikat DNA dan diproduksi dalam jumlah besar selama aktivasi dan proliferasi limfosit T dan monosit. Protein ini mengikat urutan tertentu dari DNA seluler dan urutan LTR serupa dari DNA provirus dan menginduksi transkripsi DNA seluler dan DNA provirus. Dengan menginduksi transkripsi DNA provirus, ia melakukan transisi virus dari keadaan tidak aktif ke keadaan aktif dan, karenanya, dari infeksi persisten menjadi infeksi produktif. Provirus dapat tetap dalam keadaan tidak aktif untuk waktu yang sangat lama. Aktivasi virus adalah momen kritis dalam interaksinya dengan sel.
Sejak virus menembus sel, periode infeksi HIV dimulai - status pembawa virus, yang dapat berlangsung 10 tahun atau lebih; dan sejak virus diaktifkan, penyakit dimulai - AIDS. Dengan bantuan gen pengatur dan produknya, virus mulai bereproduksi secara aktif. Protein TAT dapat meningkatkan laju reproduksi virus hingga 1000 kali lipat. Transkripsi virus bersifat kompleks. Transkripsi ini meliputi pembentukan mRNA panjang penuh dan subgenomik, penyambungan mRNA, dan kemudian terjadi sintesis protein struktural dan pengatur.
Sintesis protein struktural terjadi sebagai berikut. Pertama, poliprotein prekursor Pr55Gag (protein dengan berat molekul 55 kDa) disintesis. Ini berisi 4 domain utama: matriks (MA), kapsid (CA), nukleokapsid (NC), dan domain rb, dari mana, sebagai hasil pemotongan Pr55Gag oleh protease virus (dipotong sendiri dari protein prekursor lain, Gag-Pol), protein struktural p17, p24, p7, dan rb terbentuk, masing-masing. Pembentukan poliprotein Pr55Gag adalah kondisi utama untuk pembentukan partikel virus. Protein inilah yang menentukan program morfogenesis virion. Secara berurutan mencakup tahapan pengangkutan poliprotein Gag ke membran plasma, interaksi dengannya, dan interaksi protein-protein selama pembentukan partikel virus dan tunasnya. Pr55Gag disintesis pada poliribosom bebas; Molekul protein diangkut ke membran, di mana mereka ditambatkan oleh daerah hidrofobiknya. Domain CA memainkan peran utama dalam menciptakan konformasi asli protein Gag. Domain NC memastikan penyertaan (dengan bantuan "jari-jari sengnya") dari 2 molekul RNA genomik dalam komposisi partikel virus yang terbentuk. Molekul poliprotein awalnya dimerisasi karena interaksi domain matriks. Kemudian dimer bergabung menjadi kompleks heksamerik (dari 6 unit) sebagai hasil dari interaksi domain CA dan NC. Akhirnya, heksamer, bergabung di permukaan lateralnya, membentuk virion bulat yang belum matang, di mana RNA virus genomik terkandung, ditangkap oleh domain NC.
Protein prekursor lain, Prl60Gag-Pol (protein dengan berat molekul 160 kDa), disintesis sebagai hasil dari frameshift oleh ribosom selama translasi ujung 3' gen gag di wilayah yang terletak tepat di hulu wilayah yang mengkode protein rb. Poliprotein Gag-Pol ini mengandung urutan protein Gag yang tidak lengkap (1-423 asam amino) dan urutan Pol yang mencakup domain PR, RT, dan IN. Molekul poliprotein Gag-Pol juga disintesis pada poliribosom bebas dan diangkut ke membran plasma. Poliprotein Prl60Gagpol mengandung semua situs interaksi intermolekul dan situs pengikatan membran yang melekat pada poliprotein Gag. Oleh karena itu, molekul poliprotein Gag-Pol menyatu dengan membran dan, bersama dengan molekul Gag, termasuk dalam virion pembentuk, yang mengakibatkan munculnya protease aktif dan dimulainya proses pematangan virion. Protease HIV-1 sangat aktif hanya dalam bentuk dimer, oleh karena itu, untuk pemisahan diri dari Prl60Gag-Pol, diperlukan dimerisasi molekul-molekul ini. Pematangan virion terdiri dari fakta bahwa protease aktif yang dilepaskan memotong prl60Gag-Pol dan Gag55 di tempat-tempat yang dikenalinya; protein p17, p24, p7, p6, revertase, integrase terbentuk dan asosiasinya ke dalam struktur virus terjadi.
Protein Env disintesis pada ribosom yang terkait dengan membran retikulum endoplasma, kemudian diglikosilasi, dipotong oleh protease seluler menjadi gp120 dan gp41, dan diangkut ke permukaan sel. Dalam hal ini, gp41 menembus membran dan mengikat domain matriks molekul protein Gag yang terkait dengan permukaan bagian dalam membran. Hubungan ini dipertahankan dalam virion dewasa.
Dengan demikian, perakitan partikel virus terdiri dari agregasi protein prekursor dan molekul RNA terkait pada membran plasma sel inang, pembentukan virion yang belum matang dan pelepasannya melalui tunas dari permukaan sel. Selama tunas, virion mengelilingi dirinya dengan membran sel tempat molekul gp41 dan gp120 tertanam. Selama tunas atau, mungkin, setelah pelepasan virion, pematangannya terjadi, yang dilakukan dengan bantuan protease virus dan terdiri dari pemotongan proteolitik protein prekursor Pr55Gag dan Prl60Gag-Pol menjadi protein virus dewasa dan asosiasinya menjadi kompleks struktural tertentu. Peran utama dalam proses morfogenesis virus dimainkan oleh poliprotein prekursor Pr55Gag, yang mengatur dan merakit virion yang belum matang; proses pematangannya diselesaikan oleh protease virus tertentu.
Penyebab defisiensi imun
Salah satu penyebab utama defisiensi imun pada infeksi HIV adalah kematian massal sel T-helper. Hal ini terjadi sebagai akibat dari peristiwa-peristiwa berikut. Pertama, sel T-helper yang terinfeksi virus mati karena apoptosis. Dipercayai bahwa pada pasien AIDS, replikasi virus, apoptosis, dan penurunan jumlah sel T-helper saling berhubungan. Kedua, sel T-killer mengenali dan menghancurkan sel T yang terinfeksi virus atau yang membawa molekul gpl20 yang teradsorpsi, serta sel T-helper yang terinfeksi virus dan yang tidak terinfeksi virus, yang membentuk simplas (sinsitium) yang terdiri dari beberapa lusin sel (beberapa di antaranya mati sebagai akibat dari reproduksi virus di dalamnya). Akibat rusaknya sejumlah besar sel T-helper, terjadi penurunan ekspresi reseptor membran pada limfosit B terhadap interleukin-2, sintesis berbagai interleukin (faktor pertumbuhan dan diferensiasi limfosit B - IL-4, IL-5, IL-6, dll.) terganggu, sehingga terjadi gangguan fungsi sistem T-killer. Aktivitas sistem komplemen dan makrofag ditekan. Makrofag dan monosit yang terinfeksi virus tidak mati dalam waktu lama, tetapi tidak mampu mengeluarkan virus dari tubuh. Akhirnya, karena kesamaan struktural dan antigenik gpl20 dengan reseptor beberapa sel epitel tubuh (termasuk reseptor trofoblas yang memediasi transmisi transplantasi HIV), antibodi antireseptor dengan spektrum aksi yang luas disintesis. Antibodi tersebut mampu memblokir berbagai reseptor seluler dan mempersulit perjalanan penyakit dengan gangguan autoimun. Konsekuensi dari infeksi HIV adalah kekalahan semua mata rantai utama sistem imun. Pasien seperti itu menjadi tidak berdaya melawan berbagai macam mikroorganisme. Hal ini menyebabkan perkembangan infeksi oportunistik dan tumor. Bagi pasien dengan infeksi HIV, risiko mengembangkan setidaknya tiga jenis kanker meningkat: Sarkoma Kaposi; karsinoma (termasuk kanker kulit); Limfoma sel B, yang terjadi karena transformasi ganas limfosit B. Namun, HIV tidak hanya bersifat limfositotropik, tetapi juga neurotropik. Ia menembus ke dalam sel-sel sistem saraf pusat (astrosit) baik melalui endositosis yang diperantarai reseptor maupun melalui fagositosis limfoblas yang terinfeksi virus oleh astrosit. Ketika virus berinteraksi dengan astrosit, simplas juga terbentuk, yang memfasilitasi penyebaran patogen melalui saluran antarsel. Virus dapat bertahan lama di makrofag dan monosit, sehingga mereka berfungsi sebagai reservoir dan distributornya di dalam tubuh, mampu menembus semua jaringan. Makrofag yang terinfeksi memainkan peran utama dalam masuknya HIV ke dalam sistem saraf pusat dan kerusakannya. Pada 10% pasien, sindrom klinis primer dikaitkan dengan kerusakan sistem saraf pusat dan bermanifestasi sebagai demensia. Dengan demikian, orang yang terinfeksi HIV ditandai oleh 3 kelompok penyakit - infeksi oportunistik,penyakit tumor dan kerusakan pada sistem saraf pusat.
Epidemiologi Infeksi HIV
Sumber penularan HIV hanya dari satu orang, yaitu orang sakit atau pembawa virus. Human immunodeficiency virus (HIV) terdapat dalam darah, sperma, cairan serviks; pada ibu menyusui, dalam ASI. Penularan terjadi melalui hubungan seksual, melalui darah dan sediaannya, serta dari ibu ke anak sebelum, selama, dan setelah melahirkan. Kasus penularan virus melalui makanan, minuman, dan gigitan serangga belum diketahui.
Kecanduan narkoba berkontribusi terhadap penyebaran AIDS. Insiden HIV meningkat setiap tahun. Menurut WHO, dari tahun 1980 hingga 2000, 58 juta orang terinfeksi HIV. Pada tahun 2000 saja, 5,3 juta orang terinfeksi di seluruh dunia, dan 3 juta orang meninggal karena AIDS. Pada tanggal 1 Januari 2004, 264 ribu orang yang terinfeksi HIV terdaftar di Rusia. Setengah dari orang yang terinfeksi HIV meninggal dalam waktu 11-12 tahun sejak saat infeksi. Pada awal tahun 2004, dari setiap 100 ribu warga Rusia, sekitar 180 hidup dengan diagnosis "infeksi HIV". Diperkirakan bahwa dengan tingkat morbiditas ini, jumlah total orang yang terinfeksi HIV di Rusia pada tahun 2012 akan menjadi 2,5-3 juta orang. Kompleksitas perang melawan infeksi HIV bergantung pada sejumlah alasan: pertama, tidak ada metode pengobatan dan pencegahan khusus yang efektif; Kedua, masa inkubasi infeksi HIV dapat melebihi 10 tahun. Durasinya bergantung pada saat aktivasi limfosit T dan DNA provirus yang terkandung dalam kromosomnya. Masih belum jelas apakah setiap orang yang terinfeksi virus tersebut ditakdirkan untuk AIDS atau apakah pembawa virus jangka panjang tanpa penyakit mungkin terjadi (yang tampaknya tidak mungkin). Terakhir, ada beberapa virus imunodefisiensi manusia (HIV-1, HIV-2), perbedaan antigenik di antara keduanya mencegah pembentukan kekebalan silang. Penemuan virus imunodefisiensi simian (SIV) menjelaskan pertanyaan tentang asal usul HIV. SIV mirip dengan HIV dalam organisasi genomnya, tetapi berbeda secara signifikan dalam urutan nukleotidanya. HIV-2 menempati posisi perantara antara HIV-1 dan SIV dalam sifat serologisnya, dan lebih dekat dengan SIV dalam urutan nukleotidanya. Dalam hal ini, VM Zhdanov menyarankan bahwa virus HIV-1, HIV-2 dan SIV berasal dari nenek moyang yang sama. Ada kemungkinan, menurut R. Gallo, bahwa salah satu SIV entah bagaimana memasuki tubuh manusia, di mana ia mengalami serangkaian mutasi, yang mengakibatkan munculnya HIV-1, HIV-2 dan bentuk lainnya.
Gejala Infeksi HIV
Virus imunodefisiensi manusia memiliki beberapa ciri yang sangat menentukan patogenesis penyakit ini. Virus ini memiliki tingkat reproduksi yang sangat tinggi, yang ditentukan oleh elemen pengaturnya (hingga 5.000 virion disintesis dalam 5 menit pada tahap aktif). Karena adanya protein fusi (gp41), virus menginduksi pembentukan struktur sinsitial yang luas karena fusi T-helper yang terinfeksi dan tidak terinfeksi, yang mengakibatkan kematian massal mereka. Molekul protein gpl20 yang terbentuk dalam jumlah besar beredar bebas dalam darah dan mengikat reseptor T-helper yang tidak terinfeksi, sehingga mereka juga dikenali dan dihancurkan oleh T-killer. Virus dapat menyebar melalui saluran antarsel dari sel ke sel, dalam hal ini menjadi sulit diakses oleh antibodi.
Kriteria klinis infeksi HIV
Pada orang dewasa, infeksi HIV didiagnosis ketika mereka memiliki setidaknya dua gejala serius yang dikombinasikan dengan setidaknya satu gejala ringan dan tidak adanya penyebab defisiensi imun lainnya yang diketahui (kanker, defisiensi imun bawaan, kelaparan parah, dll.). Gejala serius meliputi:
- penurunan berat badan sebesar 10% atau lebih;
- kondisi demam yang berlangsung lama, kadang-kadang atau terus-menerus;
- diare kronis.
Gejala ringan: batuk terus-menerus, dermatitis menyeluruh, herpes zoster berulang, kandidiasis oral dan faring, herpes simpleks kronis, limfadenopati menyeluruh. Diagnosis AIDS ditegakkan jika hanya ditemukan sarkoma Kaposi, meningitis kriptokokus, pneumonia pneumocystis. Gambaran klinis penyakit ini dipengaruhi oleh infeksi oportunistik yang menyertainya.
Metode kultur human immunodeficiency virus (HIV)
HIV-1 dan HIV-2 dapat dibiakkan dalam sel-sel dari satu klon limfosit TCV4 - H9, yang diperoleh dari limfosit TCV4 leukemia. Kultur sel astrosit monolapis, tempat HIV-1 bereproduksi dengan baik, juga dapat digunakan untuk tujuan ini. Simpanse rentan terhadap HIV-1 di antara hewan.
Daya tahan virus di lingkungan luar rendah. Virus mati jika terkena sinar matahari dan radiasi UV, hancur pada suhu 80 °C dalam waktu 30 menit, dan jika diobati dengan disinfektan yang biasa digunakan - dalam waktu 20-30 menit. Untuk mendisinfeksi bahan yang mengandung virus, perlu menggunakan disinfektan mikobakterisida, karena efektif terhadap mikroorganisme dengan daya tahan tertinggi.
Diagnostik laboratorium infeksi HIV
Metode utama untuk mendiagnosis pembawa virus dan infeksi HIV adalah enzim immunoassay. Namun, karena gpl20 memiliki kesamaan struktural dan antigen dengan reseptor beberapa sel manusia, termasuk reseptor yang mengangkut imunoglobulin melalui sel epitel selaput lendir, antibodi yang terkait dengan antibodi terhadap gpl20 dapat muncul di dalam tubuh. Dalam kasus ini, mungkin ada hasil ELISA positif palsu. Oleh karena itu, semua serum subjek yang bereaksi positif menjalani analisis tambahan menggunakan metode imunoblotting, atau Western blotting. Metode ini didasarkan pada identifikasi antibodi yang diteliti setelah pemisahan elektroforesisnya dan pengujian selanjutnya menggunakan antibodi anti-spesies berlabel. Metode virologi jarang digunakan karena kompleksitas kultur virus. Klon limfosit H9 digunakan untuk mendapatkan antigen virus - komponen yang diperlukan dari sistem uji diagnostik. Metode CPR memungkinkan pendeteksian virus pada tahap awal viremia.
Pengobatan Infeksi HIV
Perlu ditemukan atau disintesis obat-obatan yang secara efektif menekan aktivitas reverse transcriptase (revertase) atau protease virus. Obat-obatan tersebut akan mencegah pembentukan DNA provirus dan (atau) menghambat reproduksi virus secara intraseluler. Strategi modern untuk mengobati pasien yang terinfeksi HIV didasarkan pada prinsip penggunaan gabungan obat-obatan yang menghambat protease virus (salah satu obat) dan reversease (2 obat yang berbeda) - terapi gabungan (tiga). Di Rusia, untuk pengobatan pasien yang terinfeksi HIV, penggunaan gabungan 2 obat dalam negeri direkomendasikan: fosfazid dan krixivan, yang secara khusus menekan reproduksi HIV pada tahap awal dan akhir reproduksi, terutama dengan berkurangnya aktivitas azidotimidin.
Masalah profilaksis spesifik adalah perlunya menciptakan vaksin yang akan memastikan pembentukan kekebalan yang diperantarai sel yang efektif berdasarkan limfosit sitotoksik spesifik virus tanpa produksi antibodi yang signifikan. Kekebalan tersebut disediakan oleh sel pembantu Thl. Ada kemungkinan bahwa antibodi, termasuk yang menetralkan virus, tidak hanya tidak efektif dalam menekan infeksi HIV, tetapi pada tingkat yang tinggi mereka menekan kekebalan yang diperantarai sel. Oleh karena itu, vaksin anti-HIV harus memenuhi, pertama-tama, dua persyaratan utama: a) benar-benar aman dan b) merangsang aktivitas limfosit T-sitotoksik. Efektivitas berbagai varian vaksin yang diperoleh dari virus yang dimatikan (dinonaktifkan) dan dari antigen individu dengan sifat perlindungan yang tinggi sedang dipelajari. Antigen tersebut dapat diisolasi dari virion itu sendiri atau disintesis secara kimia. Sebuah vaksin yang dibuat berdasarkan metode rekayasa genetika telah diusulkan. Ini adalah virus vaksinia rekombinan yang membawa gen HIV yang bertanggung jawab untuk sintesis antigen dengan sifat imunogenik yang kuat. Pertanyaan tentang efektivitas vaksin ini membutuhkan waktu yang cukup lama karena masa inkubasi infeksi HIV yang panjang dan variabilitas patogen yang tinggi. Penciptaan vaksin yang sangat efektif terhadap HIV merupakan masalah mendasar yang mendesak.

